Анализ биомаркеров в пробах нефти с использованием GC×GC-HRTOFMS с источником ионов, сочетающим электронную ионизацию (EI) и фотоионизацию (PI) [Применение GC-TOFMS]
НОВОСТИ JEOL, том 53, № 9
Масааки Убуката и Ёсихиса Уэда
Бизнес-подразделение MS, JEOL Ltd.
Два типа проб нефти были проанализированы с помощью «JMS-T200GC AccuTOFTM GCx-plus», последней модели JEOL GC-TOFMS (газовый хроматограф-времяпролетный масс-спектрометр), который имеет высокое разрешение по массе и возможности высокоскоростной регистрации масс-спектров. в сочетании с источником фотоионизации и системой ГХ×ГХ. Несколько видов биомаркеров, таких как 18-норабиотан, холестан, гопан, адамантан, ицеан и диамантан, можно разделить и селективно обнаружить с помощью ГХ×ГХ и фотоионизации.
Введение
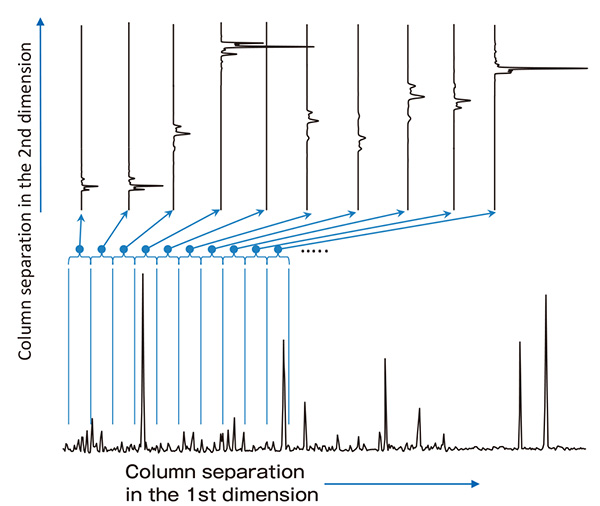
В результате недавнего прогресса в технологиях газовой хроматографии (далее именуемой «ГХ»), особенно для технологий капиллярных колонок, было разработано множество капиллярных колонок с различными возможностями разделения. Кроме того, была разработана комплексная двухмерная ГХ (далее «ГХ×ГХ») с использованием возможностей капиллярной колонки для разделения химических веществ очень сложного состава [1, 2]. Системы ГХ×ГХ состоят из последовательно соединенных капиллярных колонок двух типов с разными режимами разделения. Кроме того, между первой и второй колонками размещена система криоловушки (термомодулятор) для регулирования подачи пробы во вторую колонку. Эта двухколоночная система позволяет ГХ×ГХ использовать два разных режима разделения в одном анализе. Компоненты разделяются в первой колонке, криоулавливаются в течение 5-10 секунд, а затем быстро высвобождаются термомодулятором во вторую колонку, имеющую узкий внутренний диаметр и короткую длину. Этот процесс означает, что элюированные компоненты из первой колонки улавливаются и высвобождаются с интервалами от 5 до 10 секунд, а затем непрерывно и быстро разделяются во второй колонке. В результате двумерная хроматограмма содержит две оси времени удерживания, одну для первичной колонки и одну для вторичной колонки.
В общем, квадрупольные масс-спектрометры (далее именуемые «QMS») широко используются для измерений ГХ-МС. Однако эти системы, как правило, не подходят в качестве ГХ-ГХ-детектора. Как описано ранее, вторая колонка системы ГХ×ГХ имеет уникальную геометрию (узкий диаметр и короткая длина), что позволяет очень быстро разделять компоненты. Эта функция приводит к хроматографически узкой ширине пиков, что требует высокой скорости сбора данных для получения достаточного количества точек данных по каждому пику аналита. Если используется QMS, то количество точек данных, измеренных для пиков второго измерения на хроматограмме, ограничено, что приводит к низкому качеству двумерных хроматографических данных. Поэтому не оптимально использовать систему QMS в качестве детектора для ГХ×ГХ.
Чтобы преодолеть эту проблему, компания JEOL разработала времяпролетный масс-спектрометр газового хроматографа (далее именуемый GC-TOFMS) как с высоким разрешением по массе (R = 10,000 50), так и с высокой скоростью сбора данных масс-спектра (до 2004 Гц). что оптимально для комбинирования с GC×GC. Эта комбинированная система ГХ×ГХ-ВПМС была впервые представлена в 3 г. и широко используется для анализа различных сложных проб [7-4]. В этом отчете мы используем наши XNUMXth Модель поколения ГХ-ВПМС «JMS-T200GC AccuTOF™ GCx» с дополнительным источником фотоионизации и системой ГХ×ГХ для анализа биомаркеров в пробах нефти.
Система ГХ×ГХ-ПИ-ВПМС
Система ГХ×ГХ
Система термомодулятора Zoex Corporation ZX2 GC×GC использовалась с нашей системой GC-TOFMS. Принципиальные схемы термомодулятора ГХ×ГХ представлены на рис. 1. Этот блок модулятора был помещен между двумя капиллярными колонками для криоулавливания компонентов, элюирующихся из первой колонки, с помощью «холодного струйного газа» и для выпустите их, используя «горячий реактивный газ». Поскольку «горячий струйный газ» распыляется в течение очень короткого времени (300-400 мсек) с регулярным интервалом (5-10 секунд), выделяющиеся компоненты вводятся во вторую колонку через каждый интервал регулярно, в результате двумерное хроматографическое разделение достигается, как показано на рис. 2.
Рис.1 Схема модулятора ГХ×ГХ
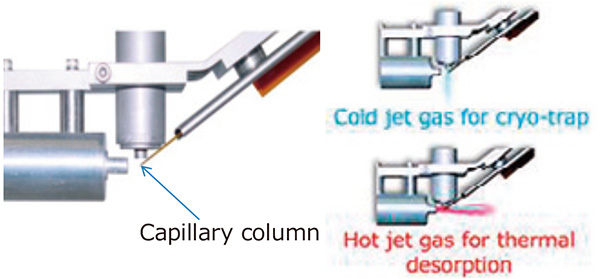
Рис.2 Концептуальный вид двумерной хроматограммы, полученной с помощью ГХ×ГХ
Источник фотоионизации (ИП)
Наиболее часто используемым методом ионизации для ГХ-МС является электронная ионизация (ЭИ). EI — это метод жесткой ионизации, в котором для ионизации аналитов используются электроны высокой энергии, в результате чего образуется множество ионов-фрагментов. Эти масс-спектры могут быть очень полезны для химического структурного анализа целевых соединений и могут быть сопоставлены с поисковыми библиотеками MS, такими как база данных NIST, чтобы помочь подтвердить идентичность целевых соединений. Однако спектры ЭУ часто могут иметь молекулярные ионы низкой интенсивности, что может затруднить оценку элементного состава по измеренной точной массе. В результате этот метод не всегда является идеальным методом ионизации для этих целей. В качестве альтернативы, методы мягкой ионизации, в которых для ионизации аналитов пробы используются низкоэнергетические методы, могут использоваться для генерации молекулярных ионов более высокой интенсивности. В области анализа ГХ-МС химическая ионизация (ХИ) является наиболее распространенным доступным методом мягкой ионизации. JEOL предлагает не только ХИ, но также полевую ионизацию (FI) и фотоионизацию (PI) в качестве дополнительных методов мягкой ионизации для JMS-T200GC.
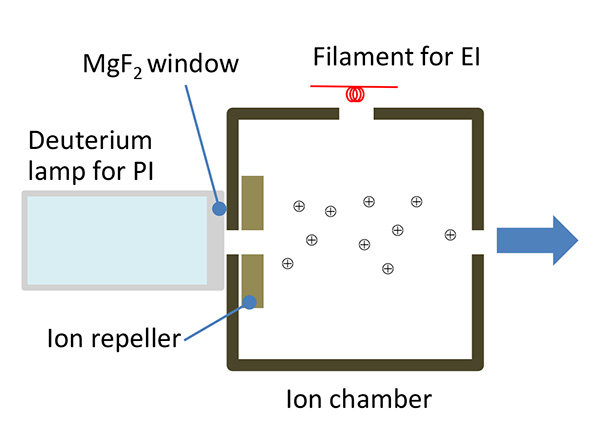
Источником фотонов ПИ является дейтериевая лампа с длиной волны излучения от 115 до 400 нм. Энергия для наименьшей длины волны (115 нм) составляет 10.8 эВ, что хорошо соответствует энергии первичной ионизации для типичных органических соединений (~ 10 эВ). В результате этот источник подходит для мягкой ионизации этих типов аналитов.
Схема источника PI показана на рис. 3. Источник PI JEOL встроен в стандартный источник EI, что обеспечивает уникальную возможность переключения между EI и PI без нарушения вакуума. Все, что необходимо для измерения ЭУ, это включить нить накала ЭУ, а затем для измерения ПИ просто выключить нить накала ЭУ и включить дейтериевую лампу.
Рис.3 Схема источника ФИ (фотоионизации)
Система TOFMS высокого разрешения
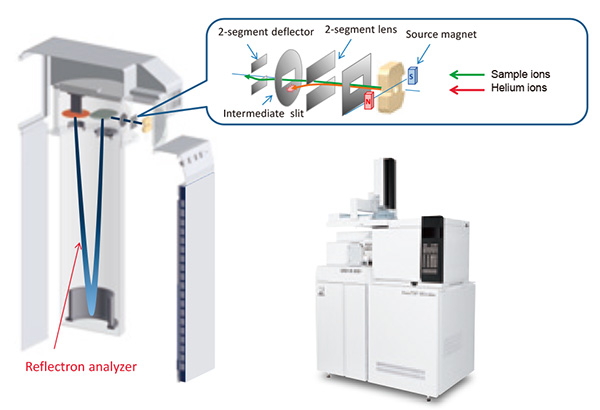
Фотография внешнего вида ГХ JEOL AccuTOF™ вместе со схемами источника ионов, системы переноса ионов и ионно-оптической системы показаны на рис. 4. Соединения, элюируемые из колонки ГХ, сначала ионизируются в источнике ионов, а затем передаются в анализатор TOF с использованием низкой кинетической энергии примерно 30 эВ. После этого ионы измеряются с помощью одноступенчатого рефлекторного времяпролетного анализатора, который ортогонально ускоряет ионы в направлении, противоположном направлению переноса ионов. Этот тип TOFMS называется «Времяпролетный масс-спектрометр с ортогональным ускорением» (oa-TOFMS).
Стоит отметить, что существуют некоторые проблемы с использованием приборов TOF в качестве детекторов ГХ-МС. В частности, газообразный гелий используется в качестве газа-носителя ГХ, что означает, что объем этого газа относительно велик по сравнению с целевыми соединениями, присутствующими в инжектируемых пробах. При ЭУ гелий также ионизируется и переносится вместе с ионами пробы в анализатор, что приводит к большому количеству ионов гелия в ионном пучке. Эти ионы могут создавать большие объемные заряды (зарядка и т. д.) внутри анализатора, что может ухудшить разрешающую способность прибора. Кроме того, для анализаторов TOFMS эти ионы гелия достигают детектора, что приводит к быстрому износу микроканальной пластины (МКП). Чтобы решить эту проблему, система JEOL GC-TOFMS была разработана по инновационной технологии, так что система переноса ионов удаляет 99.9% и более ионов гелия, образующихся в ионном источнике, путем регулировки напряжения баланса линзы.
Рис.4 Фото и схема JMS-T200GC
Биомаркерный анализ проб нефти с использованием ГХ×ГХ-ПИ-ВПМС
Биомаркеры, содержащиеся в сырой нефти и ее материнских породах, часто исследуются для индексации проб нефти и определения происхождения проб нефти. Биомаркеры представляют собой органические соединения, происходящие из живых организмов, которые присутствовали в исходном материале нефти. Эти биомаркерные молекулы, которые являются индикаторами происхождения органических веществ, осадочных сред, зрелости и т. д., могут быть использованы для определения происхождения неизвестной сырой нефти. Однако пробы нефти состоят из совокупности сотен или даже тысяч углеводородов. Ситуацию еще больше усложняет то, что биомаркеры представляют собой углеводороды с определенной структурой, обнаруженные в этих сложных образцах нефти. В результате всестороннее обнаружение биомаркеров в образцах нефти очень сложно выполнить.
В этом отчете мы будем использовать высокие возможности разделения ГХ×ГХ в сочетании с комбинированным источником EI/PI и ВПМС высокого разрешения по массе для всестороннего обнаружения биомаркеров в образцах нефти.
Условия измерения
Условия измерения перечислены в таблице 1. Для измерений ГХ×ГХ использовалась система термомодуляции ZX2 (Zoex Corporation). В качестве первой колонки использовали неполярную колонку BPX5 (SGE Corporation, длина 30 м, внутренний диаметр 0.25 мм, толщина жидкой фазы 0.25 мкм). Для второй колонки использовали более полярную колонку BPX50 (SGE Corporation, длина 3 м, внутренний диаметр 0.1 мм, толщина жидкой фазы 0.1 мкм). Для этих испытаний готовили два образца для испытаний (нефтяные фракции А и В), и количество биомаркеров оценивали и сравнивали для каждой фракции.
Таблица 1 Условия измерения
| Инструмент | Серия ГХ JEOL AccuTOF™ |
|---|---|
| Термомодулятор Zoex ZX2 | |
| 1st Column | BPX5, 30 м × 0.25 мм, 0.25 мкм |
| 2nd Column | BPX50, 3 м × 0.1 мм, 0.1 мкм |
| Период модулятора | 6 с |
| Давление на входе | 350 кПа (выходящий поток: 1.75 мл/мин) |
| Входной режим | Охлаждение на колонке, режим слежения за печью, ввод 1 мкл |
| Духовка Темп. | 50°C (2 мин) → 10°C/мин → 250°C |
| Источник ионов | Комбинированный источник ионов EI/PI |
| Режим ионизации | ПИ+ (Д2 лампа, 115~400 нм) |
| м / г ассортимент | м / г 35 ~ 700 |
| Скорость записи спектра | 25 спектров/сек |
Результаты измерений
Масс-спектры PI для холестана и адамантана, оба из которых являются типичными биомаркерами, показаны на рис. 5. Молекулярные ионы M+・ были обнаружены в качестве основного пика для каждого из этих соединений, что подтверждает эффективность PI для обнаружения этих молекулярных ионов биомаркеров.
2D TICC (хроматограммы полного ионного тока) для измерений ГХ×ГХ/ПИ показаны на рис. 6 и рис. 7 для каждого образца сырой нефти. Оба образца содержали н-алканы (CnH2n + 2) и циклоалканы ( CnH2n + 1) наряду с многочисленными химическими соединениями, обнаруженными при более позднем времени удерживания вторичной колонки. Эти соединения были идентифицированы как CnH2n-4, CnH2n-6 и CnH2n-8 которые имеют более высокую степень ненасыщенности, чем н-алканы и циклоалканы. Кроме того, эти две пробы нефтяной фракции были измерены с помощью ГХ×ГХ/ЭИ в тех же условиях. По результатам поиска в библиотеке масс-спектров ЭУ, соответствующих CnH2n-4, CnH2n-6 и CnH2n-8Нефтяная фракция А в основном содержала холестановые полициклические насыщенные углеводороды, в то время как нефтяная фракция В в основном содержала адамантеновые насыщенные мостиковые циклические углеводороды.
Затем были построены высокоселективные 2D EIC (хроматограммы извлеченных ионов) для молекулярных ионов шести химических соединений, которые широко известны как биомаркеры (таблица 2). Как показано на рис. 8 и рис. 9, 18-норабиетан, холестан и гопан были конкретно идентифицированы в нефтяной фракции A, а адамантан, ицеан и диамантан были идентифицированы в нефтяной фракции B. Затем были систематически оценены родственные соединения для этих биомаркеров. путем создания суммированных 2D EIC для CnH2n-4, CnH2n-6 и CnH2n-8 серии. 2D ЭИК для этих серий показаны на рис. 10 и рис. 11.
Эти результаты ясно показали, что биомаркеры и родственные им соединения присутствуют в каждой нефтяной фракции. Поскольку метод PI селективно производит молекулярные ионы для этих аналитов, систематическая оценка количеств биомаркеров была достигнута за счет сочетания высоких возможностей разделения ГХ × ГХ с мягкой ионизацией PI и ВПМС высокого разрешения. Кроме того, двумерные EIC для измерений PI значительно упростили интерпретацию данных и правильное присвоение идентичности биомаркеров в образцах сырой нефти.
Рис.5 Масс-спектры PI холестана и адамантана
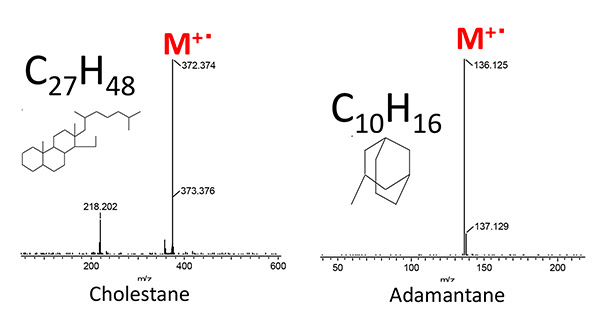
Рис.6 2D TIC нефтяной фракции А, измеренный с помощью ГХ×ГХ/ПИ
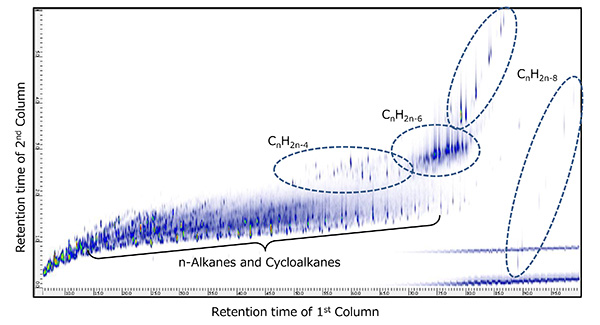
Рис.7 2D TIC нефтяной фракции B, измеренный с помощью ГХ×ГХ/ПИ
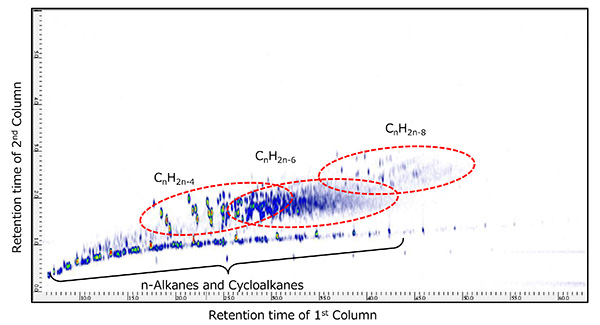
Рис.8 2D EIC нефтяной фракции A, измеренная с помощью ГХ×ГХ/ПИ
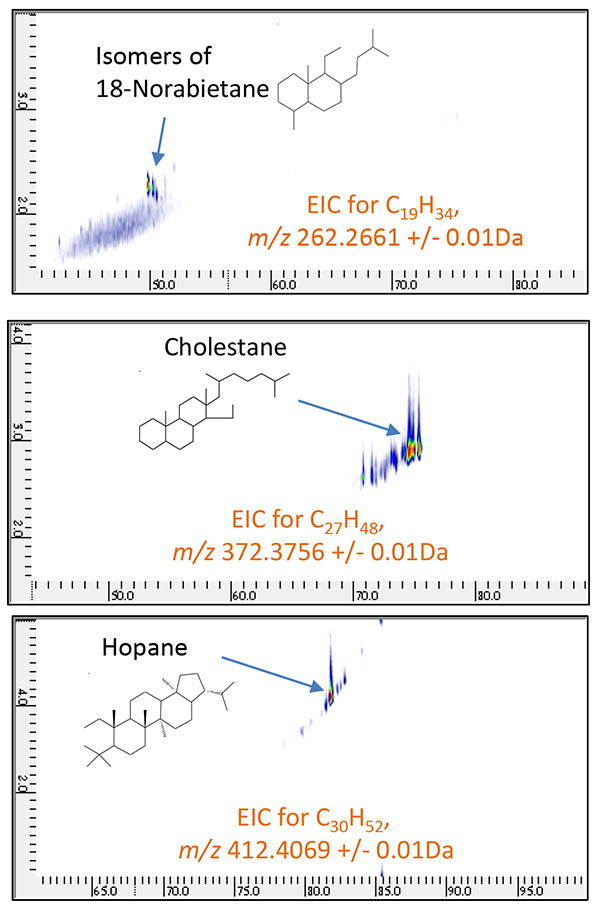
( м / г 262.2661, 372.3756, 412.4069)
Рис.9 2D EIC нефтяной фракции B, измеренная с помощью ГХ×ГХ/ПИ
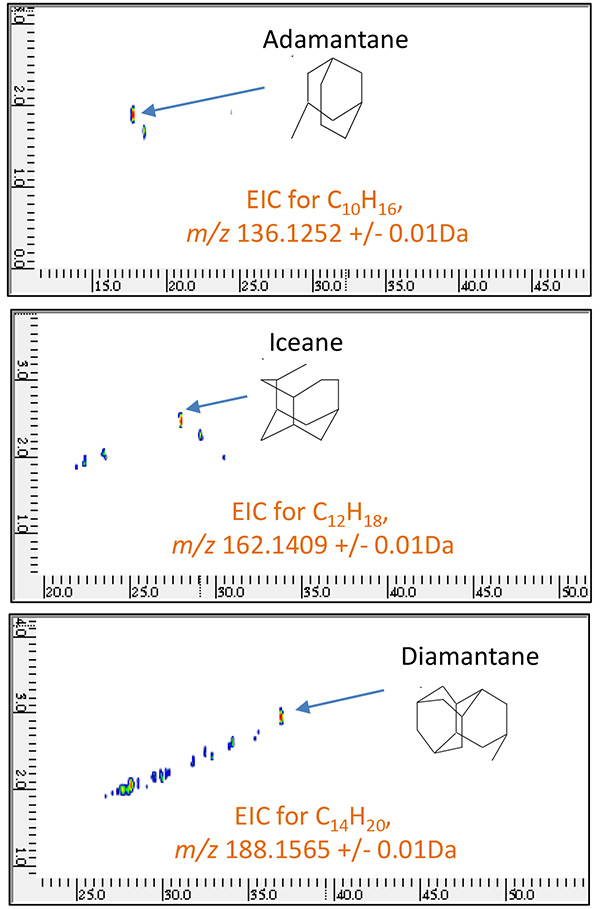
( м / г 136.1252, 162.1409, 188.1565)
Рис.10 Общий 2D EIC нефтяной фракции A, измеренный с помощью ГХ×ГХ/ПИ
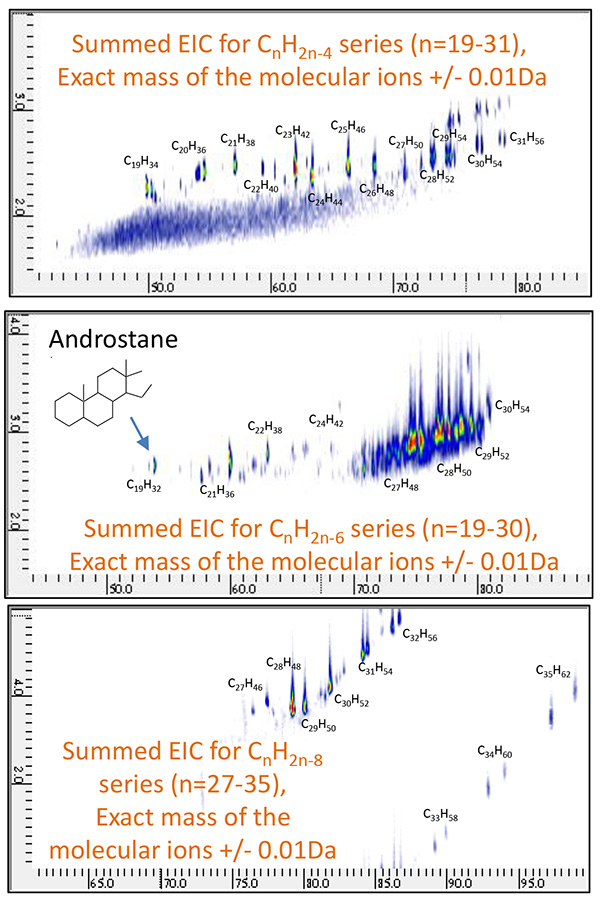
(CnH2n-4 : n=19~31, СnH2n-6 : n=19~31, СnH2n-8 : n=27~35)
Рис.11 Общий 2D EIC нефтяной фракции B, измеренный с помощью ГХ×ГХ/ПИ
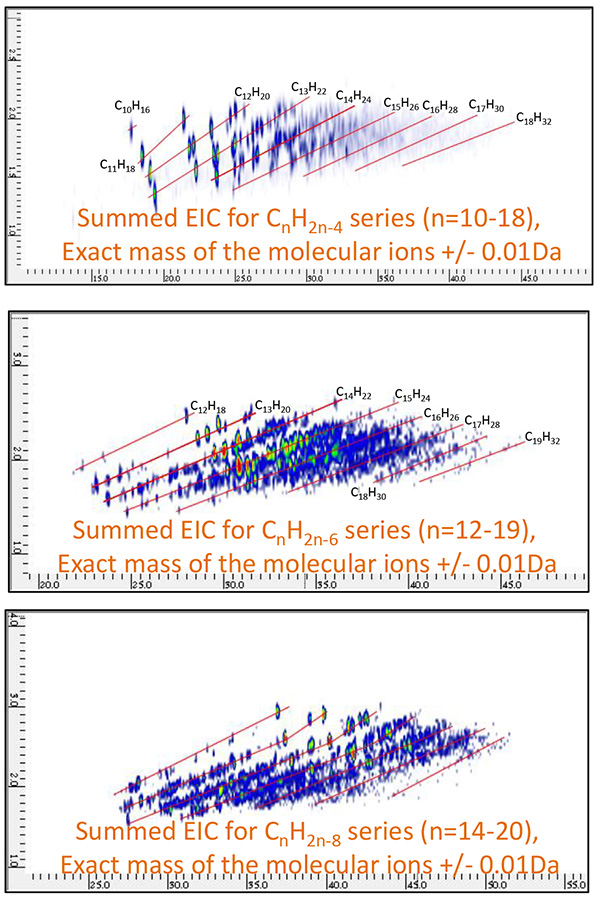
(CnH2n-4 : n=10~18, СnH2n-6 : n=12~19, СnH2n-8 : n=14~20)
Таблица 2 Типичные биомаркеры и «м / гих молекулярных ионов
| Соединения | Рациональная формула | м / г |
|---|---|---|
| 18-Норабиетане | C19H34 | 262.2661 |
| холестан | C27H48 | 373.3756 |
| Хопане | C30H52 | 412.4069 |
| адамантан | C10H16 | 136.1252 |
| Айсейн | C12H18 | 162.1409 |
| Диамантан | C14H20 | 188.1565 |
Обзор
ГХ×ГХ — это передовая технология ГХ, которая предлагает значительно более высокие возможности хроматографического разделения, чем у обычной одномерной ГХ. Чтобы максимизировать качество данных, полученных с такой возможностью высокого разделения, эффективно использовать TOFMS, которая обеспечивает как высокую скорость сбора данных, так и высокое разрешение по массе в сочетании с методами жесткой ионизации и мягкой ионизации. Система JEOL GC×GC-TOFMS, оснащенная комбинированным источником EI/PI, выполняет все это в одном корпусе.
Как сообщается в этом примечании по применению, наша новейшая ГХ×ГХ-ВПМС в сочетании с дополнительным источником EI/PI является очень мощным инструментом для анализа сложных смесей, таких как биомаркеры в образцах нефти.
Рекомендации
- З. Лю, Дж. Б. Филлипс, Ж. Хроматогр. наук, 29 227 (1991).
- Джей Си Гиддингс, Анальный. хим., 56 1258А (1984).
- GERSTEL KK Japan, Н. Очиай, «Ультрамикрообъемный анализ загрязнителей окружающей среды с использованием ГХ × ГХ-ВПМС», JEOL MS Users Meeting (2008 г.) (на японском языке).
- С. Хашимото, Ю. Такадзава, А. Фушими, Х. Ито, К. Танабэ, Ю. Шибата, М. Убуката, А. Кусай, К. Танака, Х. Оцука, К. Анэдзаки, Ж. Хроматогр. А., 1178 187 (2008).
- Ассоциация экологической оценки Кюсю, М. Уэда, «Качественный и количественный анализ органических соединений в мазуте с использованием ГХ × ГХ-HRTOFMS», Встреча пользователей JEOL MS (2010 г.) (на японском языке).
- Новости Нихонденши Том 44 (2017), стр. 40–49 (на японском языке).
- Анупам Гири и др., Анальный. хим., 89 (10) (2017), стр. 5395-5403.
Связанные товары
Решения по областям применения
Вы медицинский работник или персонал, занимающийся медицинским обслуживанием?
Нет
Напоминаем, что эти страницы не предназначены для предоставления широкой публике информации о продуктах.
