Сравнение методов трехмерной визуализации в электронной микроскопии биоматериалов
НОВОСТИ JEOL, том 53, № 8
Томохиро Харута
Департамент управления приложениями, JEOL Ltd.
Томография ПЭМ широко используется для трехмерного (3D) анализа тонких структур. В последнее время многие исследователи сосредоточили внимание на новых методах трехмерного структурного анализа с помощью SEM, FIB-SEM, Serial Block-Face SEM (SBF-SEM) и матричной томографии из-за повышения производительности компьютеров и SEM. Эти методы подходят для биологических образцов, поскольку их область наблюдения очень широка по сравнению с томографией ПЭМ. Каждый метод имеет свои преимущества и недостатки, однако существует мало примеров сравнения этих методов с использованием одной и той же выборки. В этом исследовании мы реконструировали трехмерную структуру того же образца (E.coli и фаги) методами FIB-SEM, SBF-SEM, матричной томографии и томографии TEM, а также исследовали преимущества и недостатки этих методов.
Введение
Важно знать трехмерную структуру и локализацию органелл и белковых комплексов, которые являются компонентами клеток, чтобы понять функции клеток и тканей. Эта информация играет важную роль не только в академических исследованиях, но и в разработке терапии смертельных заболеваний. Ранее томография ПЭМ использовалась для трехмерного наблюдения структуры этих наноструктур. В томографии ПЭМ мы делаем микрофотографии серийных наклонных изображений и реконструируем трехмерное изображение путем обратной проекции полученных серий изображений. Томография ПЭМ обеспечивает получение трехмерных изображений с высоким разрешением, а также имеет ограничение по толщине, определяемое пропусканием электронного луча. Поэтому трудно наблюдать трехмерное изображение целых клеток или тканей с помощью ПЭМ-томографии. Современная гистология или клеточная биология тесно связана с молекулярной биологией, поэтому важно выявить влияние морфологии и распределения наноструктур на ткани и всю клетку. По этой причине были разработаны новые микроскопические методы, которые позволяют нам наблюдать большую область, где распознаются целые клетки или ткани, и могут поддерживать высокое разрешение при распознавании комплексов органелл и белков. В этом исследовании мы сосредоточимся на трех видах новых методов трехмерного наблюдения: FIB-SEM, SBF-SEM и матричной томографии [3, 3, 3] (рис. 3).
Рис.1 Схематическая диаграмма методов трехмерной реконструкции.
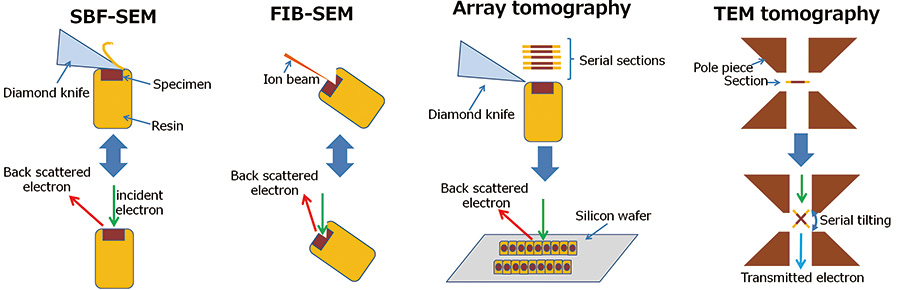
- СБФ-СЭМ:
SBF-SEM повторяет резку образца алмазным ножом и наблюдение изображения поверхности нового образца в обратно рассеянных электронах в камере образца. - ФИБ-СЭМ:
FIB-SEM повторяет распыление образца сфокусированным пучком ионов галлия и наблюдение изображения поверхности нового образца в камере для образцов в отраженных электронах. - Массивная томография:
Серийные срезы готовят с помощью ультрамикротома и монтируют на твердую подложку, например на кремниевую пластину. Эти последовательные срезы берутся для изображения в обратно рассеянных электронах один за другим и складываются по порядку. - ПЭМ томография:
Томография ПЭМ получает изображения с последовательной наклонной проекцией с помощью ПЭМ и реконструирует внутреннюю трехмерную структуру с помощью обратной проекции этих изображений.
FIB-SEM — это SEM, оснащенный колонкой со сфокусированным ионным пучком (FIB). Образец в камере для образца напыляется с помощью FIB, и распыленную поверхность можно наблюдать с помощью SEM. FIB не популярен в биологии, но популярен в материаловедении. Это связано с тем, что образцы в материаловедении (металлы, керамика и т. д.) слишком трудно разрезать алмазным ножом, но их можно превратить в тонкий срез или обнажить новую поверхность путем напыления FIB. Чтобы наблюдать трехмерную структуру с помощью FIB-SEM, мы распыляем поверхность образца и наблюдаем новую открытую поверхность с помощью изображения обратно рассеянных электронов с помощью SEM и повторяем процесс напыления и наблюдения. Наконец, мы можем реконструировать трехмерную структуру, накладывая друг на друга изображения серии последовательных разрезов [3]. Преимуществами FIB-SEM являются высокоточное определение мест распыления и подготовка тонких срезов из твердых образцов, таких как кости и металлы. С другой стороны, недостатками являются узкая область наблюдения и низкая скорость распыления.
В SBF-SEM мы используем SEM с механизмом для резки образцов алмазным ножом в камере для образцов. Чтобы реконструировать трехмерное изображение, поверхность образца разрезается алмазным ножом в камере для образца, и с помощью СЭМ наблюдается новая открытая поверхность. 3D-изображения реконструируются путем наложения изображений серий последовательных разделов, таких как FIB-SEM [3]. Преимуществами SBF-SEM являются высокая скорость резания и широкая зона резания, так как образцы разрезаются алмазным ножом. С другой стороны, недостатком SBF-SEM является необходимость специальной подготовки образцов (например, метод NCMIR), поскольку необходимо готовить образцы с высокой электронной проводимостью и сильным окрашиванием тяжелыми металлами [2]. Качество консервации наноструктур при такой специальной подготовке образцов хуже, чем при обычной подготовке для ПЭМ. Хотя проводимость образца увеличивается за счет специальной подготовки образца, иногда образец может заряжаться.
В матричной томографии сначала мы готовим образец ленты ультратонких срезов с помощью ультрамикротома, а серийные срезы монтируют на проводящую пластину, как кремниевую пластину. Эти серийные срезы наблюдают по частям с помощью РЭМ, и 3D-изображения реконструируются для укладки изображений по порядку [4]. Преимущества этого метода заключаются в следующем; Подавление зарядки очень тонких образцов, закрепленных на проводящей пластине. Низкая начальная стоимость, поскольку для этого метода требуется только обычный СЭМ и ультрамикротом, и мы можем использовать хорошие образцы, приготовленные с помощью обычных методов подготовки для ПЭМ. Недостатком этого метода является то, что требуется много ручных усилий, например, подготовка серий серийных срезов.
Сравнивать характеристики и характеристики этих трех методов почти не приходится, потому что принцип этих методов трехмерной реконструкции с РЭМ почти одинаков. То есть три метода позволяют нам делать последовательные срезы и наблюдать за новыми срезами. В этом исследовании мы наблюдали трехмерные структуры одного и того же образца этими методами и сравнивали результаты. Наконец, мы обсудим и обобщим особенности этих методов и какие образцы и анализы подходят. Кроме того, мы попытались провести анализ некоторого образца с использованием подходящих методов.
Материалы и методы
Мы использовали E.coli инфицированы фагом Т4, фагом λ и фагом φ174 в качестве образцов. Фаги — это разновидность вируса, поражающего бактерии. Размер составляет 200 нм и менее, а их морфологию невозможно наблюдать без использования электронной микроскопии (рис. 2, а-в).
Фаги вводят свой геном, такой как ДНК или РНК, в E.coli когда фаги присоединяются к E.coli. Инфицированные фаги захватывают систему транскрипции, систему трансляции и систему репликации клеток-хозяев и размножаются в клетках-хозяевах. На этой стадии мы можем наблюдать пролиферирующие фаги в E.coli (рис. 2г). Когда фаги достаточно размножаются в хозяине, фаги взрываются и выходят из клетки-хозяина. Новые пролиферирующие фаги прикрепляются и заражают новую клетку-хозяина.
Сначала мы собрали мягкий агар LB, содержащий E.coli на твердом агаре LB. Фаги были инфицированы E.coli капая раствор, содержащий фаг, на этот агар. Мы смогли распознать область, где были заражены фаги. E.coli , в виде налета после инкубации на этом агаре, и получили зараженный фагом E.coli вынимая эти таблички.
Для ПЭМ-томографии и матричной томографии образцы предварительно фиксировали 2.5% глутаровым альдегидом в 0.1 М какодилате натрия (pH 7.2) и постфиксировали 1% OsO.4 в 0.1 М какодилате натрия (рН 7.2). Неподвижные образцы были залиты эпоксидной смолой. Образцы были нарезаны ультрамикротомом на тонкие срезы, которые были помещены на кремниевые пластины для томографии. Эти тонкие срезы окрашивали ацетатом урана и цитратом свинца.
Для FIB-SEM и SBF-SEM мы применили метод NCMIR для сильного окрашивания тяжелыми металлами [3]. FIB-SEM также может использовать образцы, приготовленные обычным методом, и в этом исследовании мы применили метод NCMIR для получения сильно контрастного изображения. После фиксации и окрашивания образцы заливали эпоксидной смолой. Условия наблюдения приведены в табл. 1.
Изображения серийных срезов, полученные с помощью FIB-SEM, SBF-SEM и томографии Array, были совмещены с помощью Fiji [5], а 3D-изображения были реконструированы с помощью укладчика (System In Frontier Inc., Япония). В томографии ПЭМ ПЭМ использовалась для получения серийных наклонных изображений и трехмерных реконструкций. Полученные 3D-изображения были сегментированы и проанализированы с помощью Colorist (System In Frontier Inc., Япония).
Рис.2 ПЭМ-изображения фагов.
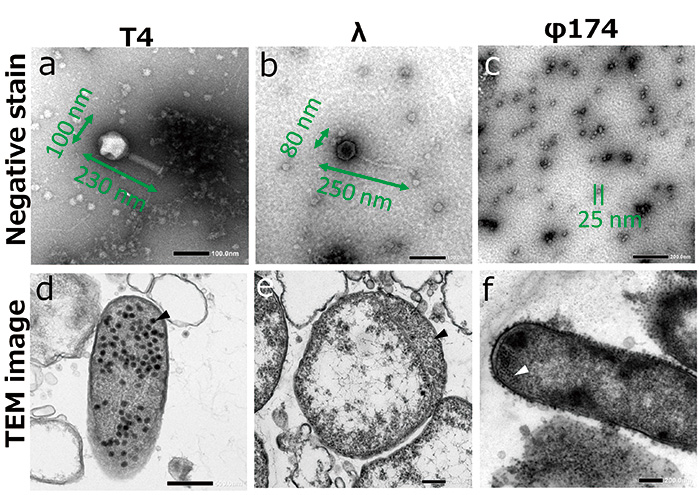
Негативные окрашенные изображения фага (ac) и пролиферирующего в E.coli (df, наконечники стрелок).
Таблица 1 Условия наблюдения трехмерных методов наблюдения.
| СБФ-СЭМ | ФИБ-СЭМ | Массивная томография | ПЭМ томография | |
|---|---|---|---|---|
| Инструмент | JSM-7800F с Gatan 3View 2XP | JIB-4610F | ДЖСМ-7800Ф | ДЖЕМ-1400Плюс |
| Зона съемки (X,Y) | 24 × 24 мкм2 | 18 × 24 мкм2 | 19 × 24 мкм2 | 3.5 × 3.5 мкм2 |
| Глубина захвата (Z) | 7.5 мкм (50 нм × 150 изображений) | 10.8 мкм (20 нм × 543 изображений) | 1.4 мкм (70 нм × 20 изображений) | 200 нм |
| Размер пикселя (X,Y) | 3 нм | 9.4 нм | 4.7 нм | 1.72 нм |
| Размер пикселя (Z) | 50 нм | 20 нм | 70 нм | 1.72 нм |
| Количество пикселей | 8192 × 8192 | 1920 × 2560 | 3840 × 5120 | 2048 × 2048 |
| Ускоряющее напряжение | 1.0 кВ | 3.0 кВ | 7.0 кВ | 120 кВ |
| Время приобретения | 2.5 час | 48 час | 4 час | 1 час |
Результаты и обсуждения
Сравнение метода 3D-реконструкции с использованием электронной микроскопии
Мы наблюдали 2D-изображения с помощью FIB-SEM, SBF-SEM (изображения поверхности массивного образца в обратно рассеянных электронах, ускоряющие напряжения составляли 1.0 кВ и 3.0 кВ соответственно), матричной томографии (изображения в обратно рассеянных электронах образца тонкого среза, установленного на кремниевой пластине, ускоряющее напряжение 7.0 кВ) и ПЭМ-томографию (проекционное изображение шлифа образца, без наклона, ускоряющее напряжение 120 кВ). FIB-SEM и SBF-SEM для наблюдения за поверхностью объемного образца уступали томографии Array и TEM для наблюдения шлифа по резкости изображений (рис. 3). Это связано с тем, что в этом образце большая часть области наблюдения была занята только смолой с низкой проводимостью, и нам приходилось наблюдать с низким ускоряющим напряжением, чтобы подавить зарядку. Качество изображения матричной томографии такое же, как у ПЭМ-томографии. Этот результат показал, что улучшение проводимости образца и наблюдение при высоком ускоряющем напряжении являются важными факторами для наблюдения за биологическими образцами в трехмерном структурном наблюдении с помощью SEM (рис. 3c). Кроме того, качество изображения FIB-SEM и SBF-SEM низкое по сравнению с двумя другими методами, но они сохранили разрешение для распознавания фаговых частиц.
Далее мы сравниваем результаты 3D-реконструкции. В ПЭМ-томографии толщина среза (200 нм) меньше диаметра E.coli (около 2 мкм), так что все изображение одного E.coli не может быть реконструирован в 3D (рис. 4 d). С другой стороны, SBF-SEM и FIB-SEM преуспели в трехмерном наблюдении большого объема (рис. 3 а, б). В матричной томографии область наблюдения в плоскости XY сравнима с таковой при методе SBF и FIB-SEM. Однако толщина объема наблюдения была уменьшена, поскольку в этом исследовании подготовленных срезов всего 4 (рис. 20с). Хотя для этого требовались зрелые навыки и длительное время, мы считаем, что можно увеличить толщину изображения трехмерной реконструкции, подготовив массовые серийные срезы и увеличив количество микрофотографий. В результате извлечения одного E.coli и сегментация фагов, содержащихся в E.coli и внеклеточная мембрана E.coli , мы могли распознать морфологию E.coli и 3D-распределение фагов любым методом, хотя есть различия в пространственном разрешении (рис. 4 eh). Сосредоточив внимание на одной фаговой частице, форма фага вытянута в направлении Z в SBF-SEM и Array томографии, поскольку разрешение по Z недостаточно для размера фагов (рис. 4 i, k). В FIB-SEM, хотя фаг был реконструирован в виде шара, однако детали изображения 3D-реконструкции теряются по сравнению с результатом ПЭМ-томографии (рис. 4 к, м). По результатам сравнений установлено, что количественный анализ морфологии E.coli и анализ распределения фагов в E.coli может быть выполнен любым методом 3D-реконструкции с помощью СЭМ, в то время как томография ПЭМ обеспечивает высокое пространственное разрешение, необходимое для наблюдения за наноструктурами, такими как фаги. Очень похожие результаты были получены с помощью SBF-SEM и FIB-SEM, которые имеют общую основу для нарезки и наблюдения объемных образцов в своих камерах для образцов. В этом исследовании с помощью SBF-SEM и FIB-SEM были получены почти одинаковые объемы, а время сбора данных с помощью SBF-SEM (2.5 часа) примерно в 20 раз меньше, чем с помощью FIB-SEM (48 часов) (таблица 1). ). Однако FIB-SEM предоставил реконструированное трехмерное изображение структуры с более высоким разрешением по оси Z, чем SBF-SEM. Разница в этом разрешении связана с разницей толщины среза: 3 нм для FIB-SEM и 20 нм для SBF-SEM.
Эти результаты были обобщены в таблице 2. Качество изображения SBF-SEM было хуже, чем у других методов, однако широкий диапазон области наблюдения и скорость наблюдения были непревзойденными для SBF-SEM. Кроме того, в образцах с высокой проводимостью качество изображения может быть улучшено, поскольку ускоряющее напряжение может быть увеличено. Благодаря вышеперечисленным характеристикам SBF-SEM подходит для очень больших образцов с высокой электропроводностью и для комплексного анализа. Например, образцы ткани большие, площадь поверхности смолы мала, а проводимость высокая. При анализе коннектома требуется комплексный анализ.
FIB-SEM требует более длительного времени сбора данных по сравнению с SBF-SEM, однако преимуществом FIB-SEM является очень высокое разрешение по оси Z. Это преимущество справедливо только для узкой области наблюдения. FIB-SEM подходит для небольших образцов, например, небольших тканей или одной целой клетки. FIB-SEM хорошо подходит для количественного анализа, поскольку для высокой количественности требуется высокое разрешение. Кроме того, можно резать кости и металлы, что позволяет выполнять трехмерный анализ твердых тканей и участков контакта между металлами и тканями.
В матричной томографии образцы остаются после наблюдения; Между тем, для увеличения наблюдаемой глубины требовались зрелые методы, которые делают серийные срезы и длительное время сбора данных. Матричная томография подходит для детального анализа редких явлений на большой площади наблюдения. Мы ожидали, что прозрачная подложка, такая как стекло, позволяет использовать различные корреляционные методы, включая корреляционную световую и электронную микроскопию (CLEM). Матричная томография эффективна для наблюдения за плавающими клетками, бактериями и эмбрионами с низкой проводимостью, окруженными смолой вокруг образцов, поскольку образцы представляют собой тонкие срезы на проводящей подложке, зарядка подавляется, и образцы можно наблюдать при высоком ускоряющем напряжении.
Рис.3 Сравнение области наблюдения и качества изображения каждого метода.
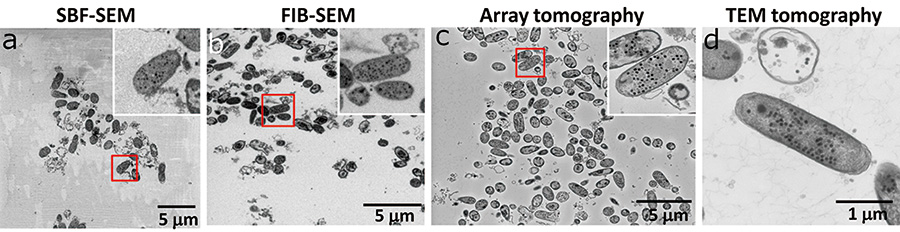
В SBF-SEM образец легко заряжается, что ухудшает качество изображения, так как малопроводящая блочная смола занимает большую область наблюдения (а). FIB-SEM также позволяет наблюдать широкую область блока смолы, но ионы галлия, распыляющие поверхность образца, подавляют зарядку (b). В матричной томографии мы смогли наблюдать изображения с высоким отношением сигнал-шум (SN), потому что зарядка была подавлена для нарезанных тонких срезов, установленных на кремниевой пластине с высокой проводимостью (c). На ПЭМ-томографии мы наблюдали только один E.coli (г).
Рис.4 Сравнение результатов 3D-реконструкции.

Мы реконструировали трехмерную структуру E.coli инфицированы фагами Т4. Объемная визуализация изображений всей области наблюдения (реклама). Сегментация изображений одного E.coli клетка, инфицированная фагами Т4 (зеленый), фагами Т4, выращенными в E.coli (оранжевый) и инфицированный (розовый) (а). Изображения сегментации одного фага Т4 в E.coli (иль).
Таблица 2. Сводка особенностей трехмерного структурного анализа с помощью электронной микроскопии.
| СБФ-СЭМ | ФИБ-СЭМ | Массивная томография | ПЭМ томография | |
|---|---|---|---|---|
| поле зрения (X,Y) | 100 мкм более | 1~100 мкм | 100 мкм | на 5 мкм меньше |
| Глубина поля зрения (Z) | Очень глубоко | Deep | Узкий | Очень узкий |
| Разрешение 3D (Z) | 50 нм | 20 нм | 70 нм | 1 нм |
| Время приобретения | Какое-то десятилетие наше | Иногда | Иногда | 1 ~ 2 часов |
| усилия по приобретению | маленький | маленький | огромный | маленький |
| Оптимальные образцы | Ткани, мозг | Ткани, Культивируемые клетки | Ткани, Эмбрион, Культивируемая клетка | Органелла, Вирус |
| Оптимальное применение | Conectome, исчерпывающий анализ | Морфологическое наблюдение, количественный анализ | Количественный анализ, CLEM | Морфологическое наблюдение |
Анализ изображения 3D-реконструкции
① Взаимосвязь морфологии E.coli инфицированных фагами Т4 и внутренней фаговой частицей
SBF-SEM было достаточно для анализа морфологии E.coli и распространение фага Т4. Мы проанализировали взаимосвязь морфологии E.coli и внутренние фаги, используя результат SBF-SEM. Сначала мы рассмотрели зависимость между объемом E.coli количество фагов (рис. 5, а). Результаты показывают, что максимальное количество внутренних фагов в E.coli составляет около 280 частиц, и нет E.coli содержащих больше фаговых частиц. Мы считали, что при дальнейшем увеличении числа фаговых частиц это увеличение вызывает E.coli взрываться. Количество содержащихся фаговых частиц имеет тенденцию к увеличению по мере увеличения объема E.coli увеличивается. Однако эта зависимость не является линейной; наблюдалась разница в количестве фаговых частиц даже в одном и том же объеме E.coli (Б и В, Г, Д на рис. 5 а). Поэтому мы выбрали характеристику E.coli (АЭ на рис. 5 а, в). Выбрано E.coli ячейки следующие. Те были небольшого объема и в них мало фаговых частиц (А, Б на рис. 5, а, в). Следующие также были небольшого объема, но в них было много фаговых частиц (КЭ на рис. 5 а, в). Другие были большого объема и в них было много фаговых частиц (F на рис. 5, а, в). E.coli клетки были разделены на три части в направлении длинной оси, центральную часть, среднюю часть и боковую часть. Мы проанализировали, какая часть частиц фага Т4 была локализована (рис. 5б). Большинство фаговых частиц локализовалось в центральной части, когда фаговых частиц было мало. Частицы фага, локализованные в центральной части, рассеивались от средней части к боковой по мере увеличения внутренних фаговых частиц. Кроме того, по мере того, как объем E.coli увеличилась, фаговые частицы в центральной части уменьшились больше, а фаговые частицы, локализованные в боковой части, увеличились. Далее мы сосредоточились на форме E.coli . Форма E.coli с небольшим количеством частиц фага Т4 имел стержнеобразную форму (рис. 5, в, б). Когда внутренние частицы фага Т4 были увеличены, E.coli расширился в направлении короткой оси, и форма стала бочкообразной (рис. 5 c CE).
Рис.5 Взаимосвязь морфологии E.coli и вовлеченные фаги.
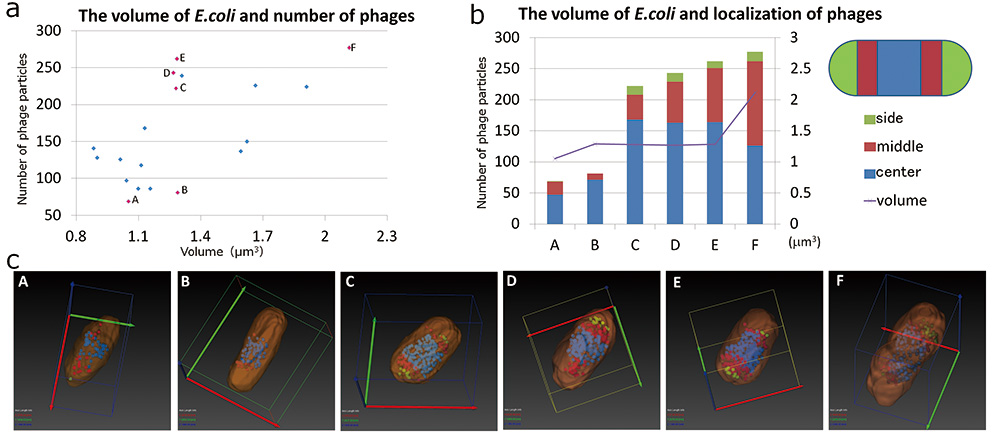
На левом графике показана зависимость объема E.coli инфицированных фагом Т4 и количество вовлеченных фагов Т4 (а). Мы выбрали шесть характерных E.coli клетки (розовая точка на левом графике, AF). Морфология этих 6 E.coli клетки, в которых участвовали фаги Т4, визуализировали путем сегментации (в), на правом графике показана зависимость объема E.coli и распределение фага Т4 (б).
② Взаимосвязь между типом фага и распределением фага в E.coli
Фаг T4 может быть распознан любым трехмерным структурным анализом с помощью SEM, поскольку он имеет сильный контраст в E.coli . Однако фаг λ и фаг φ174 было трудно распознать в E.coli потому что у них был низкий контраст в E.coli , а фаг φ174 был слишком мал (рис. 2, д, в, е). Таким образом, сравнение E.coli инфицированных фагом Т4, фагом λ и фагом φ174, выполняли с использованием изображений трехмерной реконструкции с помощью матричной томографии. Сначала мы сосредоточились на морфологии E.coli , Форма E.coli инфицированный фагом λ изменился от палочковидной структуры до шаровидной. Мы расстались E.coli инфицированные фаги на три слоя; внутренний слой, средний слой и внешний слой и исследовали, какие фаги в каком слое локализованы (рис. 6а). Результат показывает, что фаг T4 и фаг φ174 диспергированы в E.coli однако без смещения почти λ фаговая частица локализована во внешнем слое. Фаг T4 и фаг φ174 являются литическими фагами. Как только они заразятся E.coli , они начинают пролиферировать в клетках-хозяевах, и клетки-хозяева разрываются (лизируются). С другой стороны, λphage является умеренным фагом. При их заражении E.coli и вводят свой геном в клетки-хозяева, они не лизируются сразу. После заражения они встраивают свой геном в геном хозяина и ведут себя как часть хозяина (лизогенизация). Однако репрессор, который подавляет пролиферацию фага, инактивируется изменением окружающей среды, фаг начинает пролиферировать, а хозяин лизируется. Различия в наблюдаемых морфологических изменениях и локализации фагов могут быть связаны с областью пролиферации, литические фаги размножаются сразу в зараженной области, а умеренные фаги размножаются в геноме хозяина. удельная часть (рис. 174 г). В этом эксперименте мы не смогли определить первое зараженное место, но локализованное место может быть связано с первым зараженным местом.
Рис.6 Трехмерное распределение фагов в E.coli
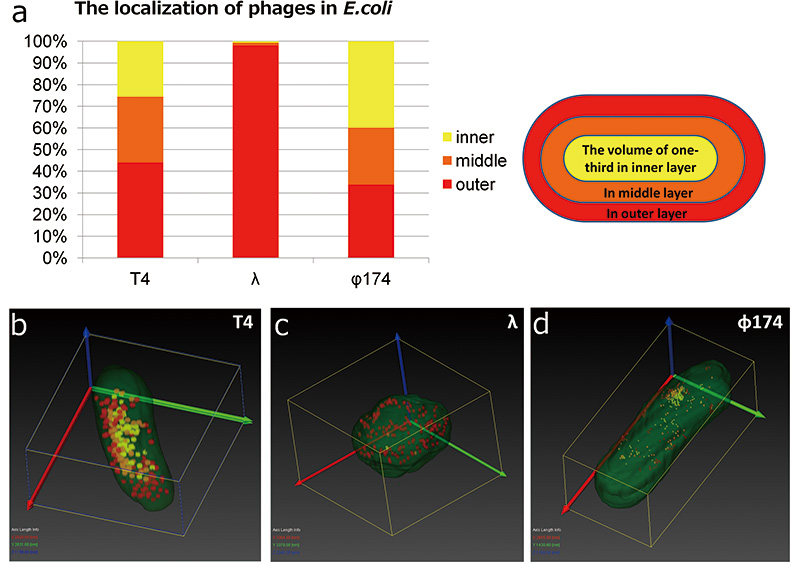
Мы сравнили распределения фагов по результатам трехмерной реконструкции структуры фага Т3, фага λ и фага φ4 с помощью матричной томографии. Мы расстались E.coli на три части; внутреннюю область, среднюю область и внешнюю область и подсчитывали количество фагов, вовлеченных в каждую часть. Фаги T4 и фаги φ174 имеют небольшой уклон в распределении, однако почти λ-фаги локализованы во внешней области (а). E.coli инфицированные λphage изменили свою форму с палочковидной на шаровидную (в).
Заключение
Каждый метод 3D-реконструкции с помощью СЭМ имеет свои сильные и слабые стороны в зависимости от подготовки образца и условий получения, таких как ускоряющее напряжение. В SBF-SEM и FIB-SEM сбор данных выполняется автоматически, с другой стороны, анализ после сегментации часто выполняется вручную. Сегментация, которая извлекает ткани и области интереса, часто выполняется на основе контраста изображения. Однако биологические образцы имеют небольшие различия в контрасте, и иногда один только контраст может не определять сегментацию. Можно сегментировать с морфологией в качестве ориентира, сохраняя высокое разрешение изображения, и, таким образом, это помогает повысить эффективность сегментации. Для SBF-SEM и FIB-SEM необходимо использовать специальные инструменты, в то время как матричную томографию можно начать с обычного SEM и ультрамикротома, но для этого потребуются некоторые навыки. Выбор того, какой метод использовать, является важной стратегией эффективного продвижения исследований. Мы надеемся, что эта статья будет полезна исследователям, которые планируют начать трехмерный анализ с помощью электронной микроскопии.
Благодарности
Автор хотел бы поблагодарить людей JEOL, которые поддерживают это исследование; Х. Нишиока за поддержку руководства в этом исследовании, М. Суга за поддержку сбора данных матричной томографии, Х. Мацусима за поддержку сбора данных с помощью FIB-SEM, Ю. Ямагути за полезное обсуждение и техническое руководство SBF- SEM, K. Hasumi за поддержку сегментации. Автор также благодарен Национальному институту технологий и оценки, Национальному институту передовых промышленных наук и технологий за предоставление E.coli и фаги.
Рекомендации
- Нотт Г., Марчман Х., Уолл Д., Лич Б. Сканирующая электронная микроскопия серийных срезов ткани мозга взрослого человека с использованием фрезерования сфокусированным ионным пучком. J Neurosci. (2008).
- Мичева КД, Смит СДж. Массивная томография: новый инструмент для визуализации молекулярной архитектуры и ультраструктуры нейронных цепей. Нейрон. (2007).
- Диринк, Т.Дж. и Бушонг, Эрик и Тор, А. и Эллисман, Марк. Методы NCMIR для 3D EM: новый протокол подготовки биологических образцов для серийной блочной сканирующей электронной микроскопии. Разрешение изображений Nat Center Microsc. 6-8. (2010).
- Денк В., Хорстманн Х. Серийная сканирующая электронная микроскопия с блочной поверхностью для реконструкции трехмерной наноструктуры ткани. PLoS Biol. (2004).
- Шинделин Дж., Арганда-Каррерас И., Фризе Э., Кайниг В., Лонгэйр М., Пицш Т., Прейбиш С., Рюден С., Заальфельд С., Шмид Б., Тиневез Ю.Ю., Уайт ДиДжей, Хартенштейн В., Элисейри К., Томанчак П., Кардона А. Фиджи: платформа с открытым исходным кодом для анализа биологических изображений. Нат Методы. (2012).
Связанные товары
Просвечивающие электронные микроскопы (ПЭМ, TEM)
Решения по областям применения
Вы медицинский работник или персонал, занимающийся медицинским обслуживанием?
Нет
Напоминаем, что эти страницы не предназначены для предоставления широкой публике информации о продуктах.
