Техническое развитие электронной криомикроскопии и вклад в науки о жизни
НОВОСТИ JEOL, том 53, № 3
Кэйичи Намба и Такаюки Като
Высшая школа передовых биологических наук Осакского университета
Трехмерная структура биологических макромолекул и их комплексов является фундаментальной информацией не только для наук о жизни, но и для медицинских наук и разработки лекарств. Электронная криомикроскопия в настоящее время привлекает большое внимание как мощный инструмент для структурного анализа с высоким разрешением в дополнение к рентгеновской кристаллографии и ЯМР, которые использовались в качестве основных методов. Как можно визуализировать и анализировать структуры биомолекул с разрешением на атомном уровне в их естественном состоянии, несмотря на то, что они легко повреждаются при относительно низком уровне электронного облучения? В данной статье описывается история и современное состояние собственного технологического развития электронной криомикроскопии, а также будущие ожидания и перспективы дальнейшего развития.
Введение
Нобелевская премия по химии 2017 года была присуждена Жаку Дюбоше (Университет Лозанны, Швейцария), Иоахиму Франку (Колумбийский университет, США) и Ричарду Хендерсону (Лаборатория молекулярной биологии MRC, Великобритания) за их новаторские работы в области разработки электронных криомикроскопия и анализ изображений для структурного анализа биологических макромолекул, таких как белки и нуклеиновые кислоты. Трехмерная (3D) структура биомолекул является базовой и важной информацией не только для наук о жизни, но и для медицинских наук и разработки лекарств, а электронная криомикроскопия (криоЭМ) за последнее время стала мощным инструментом структурного анализа с высоким разрешением. несколько лет, и теперь он зарекомендовал себя как один из основных методов структурного анализа в дополнение к обычной рентгеновской кристаллографии и ЯМР. Электронной криомикроскопии уделяется большое внимание, поскольку она позволяет достичь почти атомарного разрешения в структурном анализе только с очень небольшим количеством образцов раствора, всего несколько десятков мкг, без необходимости кристаллизации. Нобелевская премия была присуждена за признание вклада трех вышеупомянутых исследователей в качестве основателей этой технологии. Здесь мы описываем концепцию электронной криомикроскопии и анализа изображений как метода структурной биологии, историю и современное состояние нашего собственного технологического развития, а также будущий потенциал этого метода для биологических и медицинских наук посредством дальнейшего развития.
Структурный анализ биологических макромолекул методом электронной криомикроскопии
Основные механизмы, управляющие и поддерживающие биологическую активность, широко распространены среди различных организмов, от микроорганизмов, таких как бактерии и дрожжи, до многоклеточных организмов, таких как животные и растения, а также человека с функциями мозга более высокого порядка. Все эти функции определяются на основе структур белков и нуклеиновых кислот с трехмерным расположением очень многих атомов, от нескольких тысяч до десятков тысяч. Более того, их структуры не твердые, как объемные материалы из металлов и керамики, а очень динамичны и гибки и предназначены для работы за счет активного использования тепловых флуктуаций. Одной из основных задач науки о жизни является выяснение механизмов, определяющих и выражающих эти функции, и необходимо изучить трехмерные структуры стольких биологических макромолекул в различных состояниях, которые участвуют в различных биологических функциях. Количество трехмерных структур, которые нам нужно решить, будет варьироваться от нескольких сотен тысяч до нескольких миллионов.
Мощная особенность криоЭМ, особенно анализа изображений отдельных частиц, заключается в том, что нет необходимости в кристаллизации образца, которая необходима для рентгеновской кристаллографии, и в том, что в отличие от ЯМР практически нет верхнего предела размера молекулярных комплексов. Однако, поскольку большинство межатомных связей, которые поддерживают их трехмерные структуры, являются нековалентными связями, такими как водородные связи, солевые мостики и контакты Ван-дер-Ваальса, структуры очень чувствительны к повреждению облучением электронным лучом, на несколько порядков хуже. чем у металлов, керамики и полупроводников. Поэтому для получения изображений биологических макромолекул в нативном состоянии с высоким разрешением без особых повреждений необходимо заключать их в тонкую пленку аморфного льда путем быстрого замораживания их водных растворов и регистрировать их изображения с помощью просвечивающего электронного криомикроскопа (криоТЭМ) с столик для образца, охлаждаемый жидким гелием или жидким азотом до достаточно низкой температуры, чтобы предотвратить переход стекловидного льда в кристаллическое состояние. Даже при таких низких температурах доза электронов, которая может быть облучена без особого ущерба для структур атомного уровня, ограничена 3–20 e.-/Å2, поэтому криоЭМ-изображения имеют тенденцию быть чрезвычайно плохими из-за собственного статистического шума, который возникает из-за относительно небольшого числа электронов, обнаруженных в каждом пикселе детектора изображения, и шума Ландау, который возникает из-за большого распределения уровней сигналов индивидуального детектирования электронов. Поскольку отдельные молекулярные изображения, регистрируемые криоТЭМ, представляют собой двумерные проекционные изображения молекул, внедренных в пленку аморфного льда в различных ориентациях, также необходимо собрать большое количество изображений, достаточных для охвата различных ориентаций с равномерным распределением, чтобы реконструировать 2D изображение в высоком разрешении. Таким образом, важно эффективно собрать как можно больше молекулярных изображений, классифицировать их по каждой ориентации проекции и получить усредненное изображение для каждой ориентации, выравнивая положение и ориентацию молекулярных изображений, чтобы увеличить уровень сигнала при одновременном снижении шума. . Эта процедура называется усреднением класса 3D. Затем определяются относительные отношения между усредненными изображениями 2D-класса в ориентации проекции и, наконец, может быть восстановлено 2D-изображение молекулы (рис. 3). Для проведения структурного анализа с высоким разрешением важно использовать криоТЭМ и детектор изображений, способные эффективно собирать высококачественные криоЭМ-изображения с высоким разрешением. Требуются также высокоточные программы анализа изображений и высокоскоростные компьютеры. Опишем историю собственных разработок систем криоТЭМ для решения подобных задач и некоторые достижения при их использовании.
Рис. 1 Схематическая диаграмма, объясняющая процесс анализа изображения одиночной частицы.
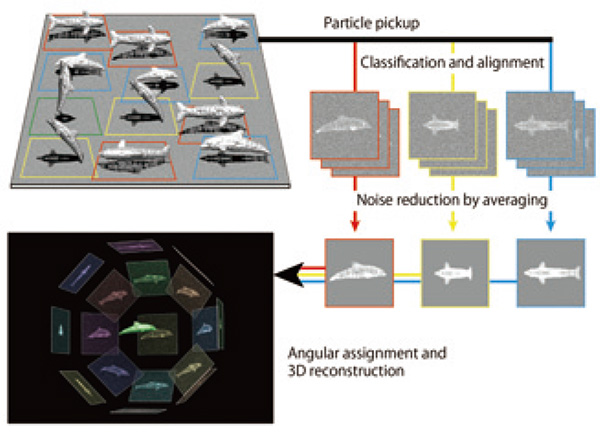
Дельфины представляют собой биомолекулы, встроенные в тонкую пленку стекловидного тела в различных ориентациях. КриоЭМ-изображения соответствуют их 2D-проекциям с высоким уровнем шума. После значительного увеличения отношения сигнал/шум за счет двухмерной классификации и усреднения многих двумерных проекций можно реконструировать трехмерное изображение.
Достижения в криоТЭМ, детекторе изображений и методах сбора и анализа данных
Автоэмиссионная электронная пушка
Первопроходцем в области криоЭМ в Японии является Ёсинори Фудзиёси (приглашенный профессор Университета Нагоя). В сотрудничестве с JEOL он спроектировал и разработал криоТЭМ с очень стабильным предметным столиком, охлаждаемым жидким гелием, впервые в мире, чтобы свести к минимуму повреждение облучения электронным лучом до предела, позволяющего записывать высококачественные криоЭМ-изображения биологических объектов. макромолекулы [1]. Я начал сотрудничать с ним примерно с 1990 года, чтобы начать использовать электронную криомикроскопию для структурного анализа бактериальной жгутиковой нити, чтобы понять ее сборку и механизм суперспирализации. В то время мы использовали рентгеновскую волоконную дифракцию и рентгеновскую кристаллографию, потому что тогда достижимое разрешение электронной криомикроскопии было довольно ограниченным, но я признал потенциал криоТЭМ с охлаждаемым жидким гелием предметным столиком для получения структурных изображений с высоким разрешением. анализ. Он научил нас основам методов криоЭМ, от подготовки сетки криоЭМ до визуализации белковых комплексов замороженных гидратов, погруженных в лед, с минимальной дозой облучения. Затем, примерно через год, мне предложил работу Цунехару Нитта, директор Центральных научно-исследовательских лабораторий Panasonic (Matsushita Electric Industrial Co., Ltd. в то время), чтобы открыть свою собственную лабораторию в подразделении Исследовательской лаборатории передовых технологий, которую Panasonic планировала создать в научном городке КейХанНа в качестве своего нового научно-исследовательского центра, ориентированного на фундаментальные исследования. Подразделение называлось Международным институтом перспективных исследований (МИАР), и мне обещали щедрое финансирование на разработку новой аппаратуры для рентгеноструктурного анализа и электронной криомикроскопии. Поэтому я попросил Ёсинори Фудзиёси присоединиться к этому новому институту Panasonic, чтобы совместно создать IIAR в качестве передового исследовательского центра структурной биофизики. Мы попросили JEOL внедрить недавно разработанное устройство, автоэмиссионную электронную пушку типа Шоттки (Thermal FEG), в вышеупомянутый криоТЭМ с предметным столиком, охлаждаемым жидким гелием. Это был самый первый криоТЭМ с ФЭГ, получивший название JEM-3000SFF (Generation 3: G3) (рис. 2) [1]. Компания Panasonic основала новый институт KeiHanNa в 1994 году, и мы переехали в новое здание и оборудовали наши лаборатории этой новой криоТЕМ. Мы ожидали значительного улучшения качества и разрешения ЭМ изображения за счет высокой когерентности его электронного пучка автоэлектронной эмиссией. Улучшение было на самом деле значительным, показывая сигналы гораздо более высокого разрешения на каждом собранном нами криоЭМ-изображении. Группа Fujiyoshi стремилась решить структуры мембранных белков, таких как бактериородопсин и аквапорин, в двумерных кристаллах, а наша группа стремилась проанализировать структуру больших спиральных сборок макромолекул, таких как бактериальные жгутиковые нити. Поскольку в те дни в качестве детектора изображений использовались только фотопленки, эффективность и производительность сбора высококачественных изображений были очень низкими. Таким образом, потребовалось более нескольких лет, чтобы структурный анализ достиг разрешения, близкого к атомному, но к середине 2000-х годов мы смогли получить много важных результатов со структурами двумерных кристаллов мембранных белков и макромолекулярных комплексов с атомарным разрешением [2-2]. ]. Наш структурный анализ бактериального жгутикового филамента достиг разрешения, близкого к 4 Å, благодаря тщательному анализу изображений тщательно отобранных высококачественных крио-ЭМ-изображений филаментов, соответствующих только 40,000 XNUMX молекул флагеллина, а полипептидная основная цепь и большие боковые цепи были четко разрешены. (Рис.
Рис. 2 История развития криоТЭМ в нашей группе.

Недавно внедренные элементальные технологии и оборудование обозначены красными буквами.
Рис. 3 Молекулярная структура жгутиковой нити, выявленная с помощью криоЭМ анализа изображений.
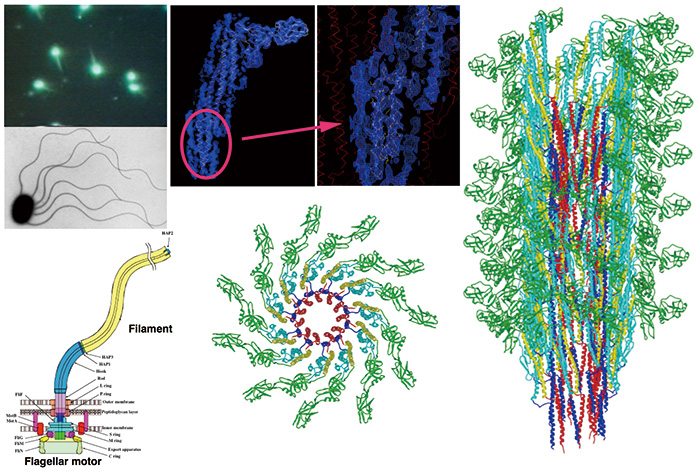
Бактериальный жгутик представляет собой подвижную органеллу с вращательным двигателем и спиральным нитевидным пропеллером. Жгутиковая нить представляет собой большую спиральную сборку из десятков тысяч молекул флагеллина. Используя криоТЭМ JEM-3000SFF и фотопленки в качестве детектора изображений, мы собрали криоЭМ-изображения и решили структуру жгутиковой нити с разрешением около 4 Å. Сворачивание основной цепи и множество крупных боковых цепей впервые были четко визуализированы с помощью криоЭМ-анализа биомолекул, что позволило нам построить полную атомарную модель этой огромной белковой сборки.
ПЗС-камера и фильтр энергии Ом-типа
В 2002 году в Университете Осаки была создана Высшая школа передовых биологических наук, а в 2004 году мы перевели нашу лабораторию в здание нанобиологии. Незадолго до этого мы получили государственное финансирование от MEXT в рамках его дополнительного бюджета и попросили JEOL представить пара недавно разработанных устройств для криоТЭМ с предметным столиком, охлаждаемым жидким гелием. Это был JEM-3200FSC (рис. 2) и представлял собой улучшенную версию криоТЭМ четвертого поколения Fujiyoshi (G4) [1], которая была представлена исследовательскому институту Riken Harima на площадке SPring-8. Одно из новых устройств представляло собой улучшенную версию энергетического фильтра Ω-типа в столбце, и это было введено для улучшения отношения сигнал/шум (S/N) криоЭМ-изображений за счет удаления большинства неупруго рассеянных электронов, которые теряли когерентность из-за потерь энергии и, следовательно, вносят вклад только в высокий фоновый шум, а не в ЭМ-изображение с высоким разрешением. Мы обнаружили почти двукратное улучшение отношения сигнал/шум изображения только за счет этого энергетического фильтра [7]. Другим устройством был ПЗС-детектор изображения 4K × 4K (TVIPS F415MP), который уже использовался для записи дифракции электронов, но не для визуализации из-за его более низкой разрешающей способности, чем у фотопленок. Его разрешающая способность ниже, потому что каждый электрон, формирующий ЭМ изображение, должен быть преобразован в фотоны тонким слоем сцинтиллятора поверх стекловолоконного соединительного блока, и изображение каждого электрона становится размытым из-за рассеяния электронов внутри сцинтиллятора. Даже с этим недостатком ПЗС-матрица заметно повысила эффективность и производительность сбора данных высококачественного изображения, поскольку мы можем видеть ЭМ-изображение и его преобразование Фурье сразу после экспонирования, что позволяет нам быстро и надежно судить о качестве и разрешение отдельных криоЭМ-изображений при сборе данных [7]. Мы также смогли значительно повысить эффективность сбора высококачественных изображений, увеличив температуру образца с 4 К до примерно 50 К, остановив подачу жидкого гелия из резервуара в колонке в отсек для образцов с верхним входом. Хотя радиационное повреждение может быть сведено к минимуму при 4 K, большинство криоЭМ-изображений страдают от локального, смещенного по направлению размытия изображения из-за увеличения заряда при облучении электронным пучком из-за чрезвычайно плохой электропроводности тонкой ледяной пленки образца при чрезвычайно низкой температуре. температура. Менее нескольких % собранных изображений можно было использовать для анализа изображений. Мы решили эту сложную проблему, повысив температуру образца примерно до 50 К, и почти все собранные изображения стали достаточно высокого качества, чтобы их можно было использовать для анализа изображений [7].
Благодаря этим технологическим усовершенствованиям и достижениям ранее многолетние проекты, от сбора данных до реконструкции 3D-изображения, были завершены в течение нескольких недель и позволили нам решить структуры множества различных интересных биомолекулярных ансамблей, таких как бактериальный жгутиковый крючок, мышечный актиновый филамент, филамент ParM, который выделяет плазмиды для деления бактериальных клеток, тонкая игольчатая трубка системы секреции патогенных бактерий типа III вирулентности и актомиозиновый ригор-комплекс, все с разрешением 5–7 Å. Нам удалось построить надежные атомные модели, чтобы получить представление о механизмах их функционирования путем пристыковки и уточнения доступных кристаллических структур к трехмерным картам [3-7]. Структура стопочного диска, образованного белком оболочки вируса табачной мозаики, была решена с разрешением 12 Å также в течение нескольких недель, что позволило визуализировать многие боковые цепи (Takashi Fujii, неопубликовано).
Сцена с боковым входом, охлаждаемая жидким гелием
Охлаждаемый жидким гелием столик для образцов, разработанный Фудзиёси в 1980-х годах, был самым популярным типом начального уровня. Он был механически очень стабилен, но электронную криотомографию нельзя было сделать, потому что столик не имел механизма наклона. Было сделано специальное приспособление для визуализации 2D-кристаллов под разными углами наклона, чтобы охватить большую часть 3D-пространства Фурье для реконструкции 3D-изображения с высоким разрешением, но это все равно требовало много времени. Поэтому Фудзиёси решил изменить дизайн своей верхней ступени входа, чтобы внедрить механизм наклона, и подал заявку на получение бюджета MEXT под названием «Специальные фонды координации содействия развитию науки и технологий» для его разработки JEOL, и я присоединился к этому проекту в качестве соавтора. В рамках этого проекта разработан криоТЭМ поколения 6 (G6) (рис. 2). Компания JEOL построила два из них и доставила в Киотский и Осакский университеты в 2006 г. [1]. Одним из основных объектов нашего исследования является бактериальный жгутиковый двигатель, который вращает сверхскрученную жгутиковую нить как спиральный пропеллер, создавая тягу для плавательной подвижности бактерий. Нам нужна подробная структурная информация о базальном теле жгутика, охватывающем клеточные мембраны, чтобы понять механизм вращения мотора, но важные компоненты мотора, такие как узлы статора, отделяются от базального тела во время его выделения и очистки путем солюбилизации детергентом. из-за их слабого связывания, и поэтому строение жгутикового мотора невозможно наблюдать в его функциональных состояниях при изоляции от клетки. Итак, с помощью этой новой криоТЕМ мы стремились разработать метод электронной криотомографии (ЭКТ) для наблюдения структур in situ биомолекулярных комплексов внутри клеток. Мы попытались внедрить метод ЭСТ с помощью этого нового криоТЭМ с механизмом наклона для визуализации функциональной двигательной структуры в клеточных мембранах путем быстрого замораживания целых бактериальных клеток на сетке образцов и записи множества их наклонных изображений для реконструкции трехмерных изображений клеток. с жгутиковыми базальными телами. Однако, поскольку диаметр клеток сальмонеллы составляет почти 3 мкм, а толщина образца, через который проходит электронный пучок, становится вдвое больше при наклоне на 1º, что является слишком толстым даже для электронов с энергией 60 кэВ, чтобы пройти и упруго рассеяться с образованием ЭМ. изображений хорошего качества, нам пришлось ждать несколько лет, чтобы визуализировать структуру базального тела in situ, пока мы не внедрили метод генной инженерии для получения «мини-клеток», чтобы сделать клетки сальмонеллы намного меньше, чем клетки дикого типа [300]. ].
Чтобы еще больше повысить эффективность и пропускную способность сбора данных изображений для анализа изображений отдельных частиц, в 2011 году мы решили изменить предметный столик для образца на тип бокового ввода оригинальной конструкции JEOL с возможностью автоматического сбора данных с помощью компьютерного управления. . Эта модифицированная версия криоТЭМ называется G6N (6-е поколение с новой модификацией) (рис. 2).
Внедрение этого предметного столика вместе с другим типом полюсного наконечника объектива привело к повышению удобства использования и разрешению изображения, превосходящему наши ожидания. Одним из стандартных методов проверки максимально возможного разрешения изображения криоТЭМ является получение ЭМ изображения испытуемого образца, такого как тонкая пленка из аморфного платино-иридиевого (Pt/Ir) сплава, в условиях относительно большого расфокусирования около 1 мкм и посмотрите на его преобразование Фурье, чтобы увидеть, как далеко простирается кольцо Тона (см. рис. 4). Это то, что мы обычно делаем для изучения разрешения криоЭМ-изображений замороженных гидратированных образцов со льдом, и такая большая расфокусировка необходима для повышения контрастности изображения с низким разрешением, чтобы сделать биомолекулы со льдом видимыми для анализа изображений. Используя тонкую пленку сплава, мы не ограничены низкой дозой электронов, которую мы должны использовать, чтобы избежать радиационного повреждения, чтобы увидеть слабый сигнал кольца Тона с максимально возможным разрешением. С помощью такого теста разрешения изображения, проведенного в день завершения установки криоТЕМ G6N, мы смогли увидеть кольцо Тона, выходящее за пределы разрешения 2.0 Å. Чтобы заставить кольцо Тона расшириться до максимально возможного разрешения в таких условиях расфокусировки, электронно-оптическая система криоТЭМ должна быть настроена на создание параллельного луча освещения на образце. К счастью, полюсная часть линзы объектива этого криоТЕМ была разработана для выполнения такого требования практически при любых условиях визуализации, которые пользователи настраивают для получения изображений, даже не подозревая об условиях параллельного освещения.
Однако были и другие проблемы. Хотя предметный столик охлаждался жидким гелием, температура образца была немного выше, чем у G4 с верхним вводом, и температуру нельзя было поднять до 50 K, как мы сделали с G4 с верхним вводом. Кроме того, поставки гелия во всем мире были ограничены, а цены на него росли. Наша установка для микроскопии была соединена трубой для извлечения гелия с Центром низких температур Университета Осаки в том же кампусе, но наша линия для извлечения гелия часто вызывала проблемы в работе Центра низких температур из-за загрязнения воздуха. Поэтому примерно в 2012 году мы решили отказаться от использования жидкого гелия. Мы заполнили жидким азотом резервуары с жидким азотом и резервуары с жидким гелием криоТЕМ G6N и обнаружили, что температуру образца можно стабильно поддерживать на уровне 77 К, точно при температуре жидкого азота. на 7-8 часов. Благодаря полному использованию программного обеспечения для управления ПЗС-камерой, предоставленного TVIPS, стало возможным почти автоматическое получение данных, что сделало сбор данных криоЭМ-изображений очень эффективным.
Рис. 4 Тонкое кольцо изображения тонкой пленки Pt/Ir, полученное с помощью прототипа CRYO ARM™.
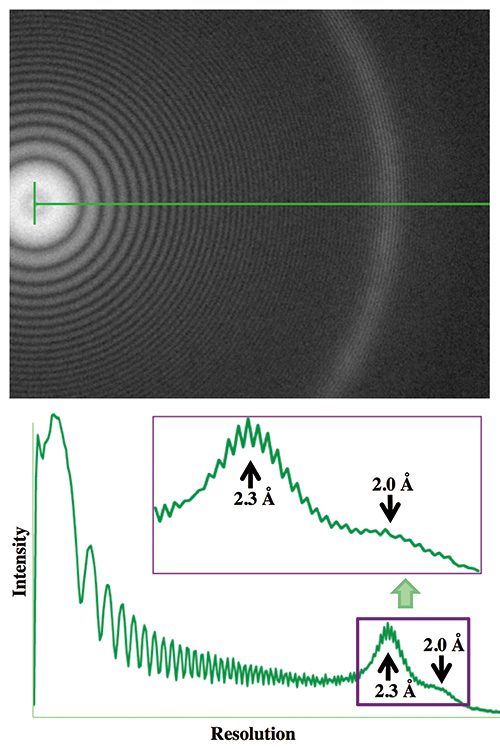
КриоЭМ изображение тонкой пленки Pt/Ir было получено с расфокусировкой 1 мкм с помощью прототипа CRYO ARM™, работающего при 200 кВ. Кольцо Тона в его преобразовании Фурье расширено до разрешения 1.8 Å.
Камера прямого детектора электронов на основе КМОП
И, наконец, в 2013 году наступило светлое время криоЭМ-поля с появлением камеры прямого детектора электронов на основе КМОП. Дэвид Агард и его коллеги из Калифорнийского университета в Сан-Франциско разрабатывали детектор электромагнитного изображения в сотрудничестве с Gatan, одним из крупнейших производителей электромагнитных камер, путем перепрофилирования устройства CMOS для детекторов рентгеновского изображения, разработанного группой в Калифорнийский университет, Беркли. Компания Gatan завершила разработку этой системы камер и выпустила ее в продажу в 2013 году под названием K2 Summit. КМОП-чип обладал замечательными характеристиками: он имел разрешение 4K на 4K пикселей, был устойчив к прямому облучению высокоэнергетическими электронами, ускоренными до 300 кэВ или даже выше, и демонстрировал минимальное размытие изображения из-за рассеяния электронов внутри очень тонкого полупроводника, обнаруживающего электроны. слоя, а самое главное, скорость сбора данных 16-мегапиксельного изображения составляла 400 кадров в секунду, что позволяло вести счет одиночных электронов. Поскольку общая доза электронов, обычно используемая для записи криоЭМ изображений, составляет от 20 до 30 e.-/Å за одну секунду экспозиции число электронов, поступающих на плоскость детектора за каждый кадр, становится ограниченным и поддающимся учету, если мощность дозы снизить примерно в 10 раз за счет увеличения времени экспозиции в 10 раз. Подсчет одиночных электронов дает нам большое преимущество в снижении уровня шума изображения. Одним из основных источников шума при записи криоЭМ-изображений является статистический шум, который велик по сравнению с сигналом, потому что количество электронов, формирующих отдельные криоЭМ-изображения, невелико из-за визуализации с низкой дозой облучения, чтобы избежать радиационных повреждений. Убежать от него невозможно. Однако подсчет отдельных электронов может свести к минимуму шум Ландау, который является собственным шумом детектора, вызванным большим распределением амплитуды сигнала, которое любой тип детектора изображения с накоплением энергии, такой как ПЗС, создает для обнаружения отдельных электронов.
Ифань Ченг из Калифорнийского университета в Сан-Франциско максимально использовал производительность этой системы CMOS-камер и разработал способ получения четких высококачественных крио-ЭМ-изображений белков с помощью видеосъемки и коррекции движения. Он и его коллеги успешно проанализировали трехмерную структуру мембранного белка, ионного канала рецептора TRPV3, который ощущает тепло и остроту, из небольшого количества образца раствора, который ускользал от кристаллизации в течение многих лет, несмотря на большие усилия группы его коллег. и опубликовал две статьи в Nature в конце 1 г. [2013, 14]. Структура была решена с разрешением 15 Å путем анализа около 3.4 100,000 изображений отдельных частиц белка, полученных из примерно 1,000 криоЭМ изображений, полученных из небольшого количества раствора образца, содержащего растворенный в детергенте белок. После обработки отдельных кадров для подсчета отдельных электронов они суммировали каждые 80 кадров, чтобы получить крио-ЭМ фильм со скоростью 5 кадров в секунду, а затем добавили эти кадры фильма с коррекцией движения, чтобы минимизировать размытие изображения, вызванное механическим дрейфом предметного столика и искажение ледяной пленки, вызванное облучением электронами, делает конечное крио-ЭМ изображение очень резким [16].
В 2 году мы смогли представить Gatan K6 Summit в нашем криоТЕМ G2N (рис. 2015) и попытались использовать его высокую производительность в качестве детектора изображений. Запись изображения в режиме видеосъемки позволила нам зафиксировать структуры различных биомолекул, включая мембранные белки, с разрешением, близким к атомному, а самое высокое разрешение, которое мы достигли, составило 2.7 Å для структуры тонкой игольчатой трубки системы секреции фактора вирулентности шигеллы III типа. (Такаши Фуджи и Юрика Ямада, не опубликовано). Поскольку достижимое разрешение в значительной степени зависит от структурной стабильности молекулы образца и толщины тонкой пленки льда на сетке криоЭМ, должно быть возможно достичь разрешения, превышающего 2.0 Å, с лучшим образцом и сеткой.
Разработка CRYOARM™
Компания FEI (с 2017 года Thermo Fisher Scientific), один из крупнейших производителей электронных микроскопов, начала разработку высокопроизводительных и удобных криоТЭМ для исследователей в области наук о жизни примерно в конце 1990-х годов и выпустила криоТЭМ под названием Polara в 2004 г. и Titan Krios. в 2008 году. Titan Krios представляет собой, в частности, удобную для пользователя систему, способную хранить 12 криоЭМ-сеток в магазине, что позволяет пользователям загружать каждую сетку на предметный столик, охлаждаемый жидким азотом примерно до 90 K, с помощью автоматического загрузочного устройства (автозагрузчика), и позволяет автоматически собирать данные изображения, указывая области для записи изображения после того, как пользователи оценили качество сетки. Titan Krios получил высокую оценку многих пользователей в области криоЭМ во всем мире из-за его высокой производительности в достижении высокого разрешения и удобства для пользователя как при трехмерном наблюдении клеточных структур с помощью ЭСТ, так и при анализе изображений отдельных частиц, поскольку оба метода требуют большого количества криоЭМ. данные изображения, которые необходимо собрать.
Компания JEOL разработала JEM-ARM200F (ARM: микроскоп атомного разрешения) в 2009 году как ПЭМ высокого разрешения для исследования материалов и получила высокую оценку в мире. Поэтому мы подумали, что JEOL следует разработать криоТЕМ на базе ARM, использующий его электронную оптику сверхвысокого разрешения, путем разработки необходимых устройств, таких как высокостабильный управляемый компьютером предметный столик с охлаждением жидким азотом, который может максимизировать производительность электронной оптики высокого разрешения. , автозагрузчик сетки криоЭМ, который более удобен и удобен в использовании, чем у Titan Krios, и система автоматического заполнения жидким азотом, а также за счет добавления внутриколонного энергетического фильтра Ω-типа для минимизации неупругого рассеяния электронов в увеличьте S/N записанных изображений. Ом-фильтр также полезен для быстрого измерения толщины ледяной пленки для оценки и оценки качества сетки ЭМ. Как раз в нужное время JSPS объявила о крупном финансировании под названием «Программа создания современной исследовательской инфраструктуры», а также о предложении и заявке на финансирование от Тошио Янагиды в качестве директора Центра количественной биологии Riken (QBiC) (также специально назначенного Профессор и почетный профессор Осакского университета; директор Центра информации и нейронных сетей) был утвержден в 2010 году для подготовки к созданию Riken QBiC. Этот бюджет был выделен Riken и Университету Осаки для их совместной исследовательской деятельности. Мы предложили использовать часть бюджета для разработки удобной для пользователя криоТЕМ с высоким разрешением и получили разрешение попросить JEOL разработать ее. Мы передали нашу идею, видение и необходимые спецификации технической команде JEOL, и они согласились начать разработку. Компания JEOL планировала завершить создание прототипа криоТЕА к весне 2014 года, и у нас было много дискуссий на многих встречах. Прозвище, которое мы придумали для этого нового криоТЕА, было CryoARM, и компания JEOL назвала его CRYO ARM™ (рис. 2). Одной из поставленных нами целей было превысить 2.0 Å как достижимое разрешение при структурном анализе биомолекулярных комплексов.
Хотя разработка затянулась по разным обстоятельствам и причинам, в мае 2016 года в корпусе нанобиологии наконец был установлен прототип криоТЭМ. В соответствии с первоначальным проектным планом, сделанным в то время, когда холодный ФЭГ еще не был доступен, этот прототип CRYO ARM был установлен с тепловым ФЭГ с ускоряющим напряжением 200 кВ. Мы исследовали кольцо Тона в преобразовании Фурье изображений тонкой пленки Pt/Ir, записанных при расфокусировке 1 мкм, и подтвердили, что кольцо Тона простирается за пределы разрешения 1.8 Å (рис. 4). С этого момента началась наша важная миссия. Мы подготовили криоЭМ-сетки многих различных биомолекулярных образцов и собрали криоЭМ-изображения для анализа их структур с помощью анализа изображений отдельных частиц, чтобы оценить производительность криоТЭМ для разрешения. Мы также тщательно изучили и оценили различные аспекты криоТЭМ, такие как удобство эксплуатации криоТЭМ и управляющего программного обеспечения, быстрота и плавность ручной работы с крио-рабочей станцией для переноса сетки криоЭМ, а также работа автозагрузчика, эффективность сбор данных с помощью автоматической записи изображений, а также пункты, которые необходимо улучшить в программном обеспечении для автоматизированного сбора данных JADAS в сторону полностью автоматизированного сбора данных, чтобы передать их инженерам JEOL. Как мы и предсказывали, с автозагрузчиком и крио-рабочей станцией часто возникало так много механических проблем, что инженерам JEOL приходилось переделывать системы и детали, иногда из новых материалов, и привозить их из Акишимы, Токио, для замены на старые. и отрегулируйте датчики и приводы, чтобы исправить эти проблемы. Это было почти каждую неделю в течение примерно полугода с момента установки. Стол для образцов был значительно переработан для повышения стабильности, а также было улучшено программное обеспечение для управления системой ПЭМ, включая введение кнопок одним нажатием на дисплей для достижения параллельного освещения и выравнивания оптики без комы. Метод криоЭМ соответствует такому большому количеству знаний, накопленных за годы его разработки, и система криоТЭМ может работать хорошо только при внедрении и реализации всех этих необходимых ноу-хау и спецификаций. Инженеры JEOL очень усердно работали, чтобы система криоТЕМ работала так, как мы хотели. Именно в феврале 2017 года все функции этого прототипа CRYO ARM™ наконец-то заработали стабильно, и с тех пор у нас никогда не было серьезных проблем.
Мы использовали β-галактозидазу в качестве тестового образца, чтобы увидеть достижимое разрешение структурного анализа с данными изображения, полученными с помощью CRYO ARM™. Мы также продолжили оценку стабильности работы аппаратного и программного обеспечения для дальнейшего улучшения и уделили особое внимание JADAS, программному обеспечению для автоматизированного сбора данных, которое JEOL разрабатывала на протяжении многих лет, чтобы сделать его удобным для использования каждым пользователем криоЭМ. оперативный сбор данных. JADAS стал практически пригодным для использования после нескольких обновлений, и летом 2017 года мы смогли собрать 2,500 изображений из криоЭМ-сетки β-галактозидазы за 3 дня. Мы собрали из них около 350,000 88,000 изображений отдельных частиц, отобрали около 2 3 хороших изображений, пройдя XNUMXD- и XNUMXD-классификацию по
Вы медицинский работник или персонал, занимающийся медицинским обслуживанием?
Нет
Напоминаем, что эти страницы не предназначены для предоставления широкой публике информации о продуктах.
