Биологическая электронная микроскопия; Поиск Evermore важных данных для новых открытий в биологических исследованиях

ИНТЕРВЬЮ 08
Роланд Флек
Профессор Королевского колледжа Лондона, Великобритания
Принципиальной основой для биомедицинских исследований является понимание клеточных и молекулярных структур. Вооружившись микроскопами JEOL, эти структуры в высоком разрешении изучает профессор Роланд Флек, директор CUI (Центра ультраструктурной визуализации) при Королевском колледже Лондона. В партнерстве с нашей компанией он работает как со сканирующими, так и просвечивающими электронными микроскопами: JSM-7800FPRIME, JEM-F200, а также другими инструментами JEOL. В центре JCAT (JEOL Centre for Advanced Technology), основанном на базе CUI в сотрудничестве с JEOL, проводят исследования не только обычными методами электронной микроскопии при комнатных температурах, но также используют криоэлектронную микроскопию.
Зачем понимать сложные биологические процессы?
Профессор Флек, глава CUI (Центра ультраструктурной визуализации) при Королевском колледже Лондона, применяет передовые технологии визуализации: просвечивающие электронные микроскопы (ПЭМ), сканирующие электронные микроскопы (СЭМ), — чтобы глубже вникнуть в сложные биологические процессы. Под «биологическими процессами» имеются в виду различные биологические явления, в том числе организация генома, передача сигналов, прохождение клеточного цикла и другие сложные системы.
В человеческом теле имеются разные органы, выполняющие уникальные функции: глаза видят, ногами ходят. Эти функции реализуются на различных пространственных уровнях: хрусталик и фоторецепторы внутри глаза вносят разный вклад в зрение, а молекулы, сгруппированные в разных частях каждого фоторецептора, выполняют свои индивидуальные задачи (одни обнаруживают свет; другие оповещают мозг о том, что свет обнаружен). Однако для измерений в молекулярных масштабах требуется увеличение приблизительно в миллион раз. Подобного увеличения не достигнуть при помощи обычных световых микроскопов — нужны микроскопы с электронным лучом, обладающие более короткой длиной волны. Электронные микроскопы же, как правило, позволяют рассматривать лишь очень тонкие образцы биоткани: толщиной в одну тысячную человеческого волоса, и для наблюдения за целой клеткой необходимо смотреть сотни таких тонких срезов.
Для изучения клеток и биотканей на электронном микроскопе необходимо подготовить подходящие образцы. Подготовка требует специальных знаний во множестве областей; нужны и исследования, проясняющие, как процесс подготовки влияет на образец с физической и химической точки зрения и как этот процесс оптимизировать. В стремлении получать от биообразцов более качественную информацию профессор Флек проводит частные исследования, направленные на усовершенствование пробоподготовки. «Еще и поэтому я так ценю сотрудничество с JEOL», — делится он.
Криопрепарирование биотканей
Биоткани скомпонованы из групп клеток. Так, сердце — орган, состоящий из нескольких тканей (миокард, кровеносные сосуды, нервы и т. д.) — выполняет различные функции исходя из того, в каком порядке скроена каждая ткань. Соответственно, для понимания функций биоткани необходимо изучить ее морфологию и структуру.
Криоэлектронная микроскопия позволяет наблюдать за биотканями путем их заморозки в исходном, «живом» состоянии и содержания в низкотемпературных условиях. Охлажденный до предельно низкой температуры образец наблюдают на «крио»-столике, установленном в электронном микроскопе. Избежать формирования кристаллического льда при замораживании образца (то есть витрифицировать: заключить образец в аморфный лед) — главное условие для повышения качества изображения и разрешающей способности в криоэлектронной микроскопии. Дело в том, что кристаллы льда наносят повреждения изначальной структуре образца. Благодаря витрификации можно изучать структуры в их естественном состоянии, не сталкиваясь с артефактами в результате химической фиксации и дегидратации, а также с разрушением микроструктуры из-за образования льда внутри клетки.
Вооружившись множеством криотехник, профессор Флек предупреждает образование кристаллов льда во время заморозки. Моментальная заморозка промежуточным хладоносителем (жидкий этан, пропан) позволяет витрифицировать образцы небольшого объема, предотвращая т. н. эффект Лейденфроста, при котором прослойка теплоизолирующего пара снижает скорость охлаждения. Этот метод предложил один из лауреатов Нобелевской премии по химии 2017 г. Жак Дюбоше: если виртифицировать маленькие индивидуально рассеянные частицы, такие как биомолекулы в водном растворе, из получившегося материала можно изготовить тонкий срез ПЭМ-образца, пригодного для анализа каждой частицы. В случае толстых срезов, состоящих из целых клеток и биотканей, используют системы для криофиксации при высоком давлении. Криофиксация при высоком давлении (HPF) основана на физических свойствах воды: давление в 2100 бар, применяемое в ходе заморозки, действует как физический криопротектор; высокое давление противодействует расширению воды при кристаллизации, тем самым замедляя образование кристаллов льда и снижая критическую скорость охлаждения, необходимую для витрификации (10,000 XNUMX°C.s-XNUMX).-1).
Аморфный лед в блоках витрифицированной биоткани заменяют на органический растворитель, затем блоки разрезают или дробят при криотемпературах (COMOVIS — «Cryo-electron microscopy of vitreous sections») и непосредственно изучают на крио-СЭМ либо изготавливают копию для ПЭМ и рассматривают на просвечивающем микроскопе. С помощью таких инновационных техник профессор Флек ищет ответы на самые разные вопросы. В частности, криофиксация при высоком давлении сейчас объединена с техниками электрической и световой стимуляции; реализуя на высоком уровне временную корреляцию между стимулом и торможением, исследователи изучают, какого рода информацию передают друг другу нервные клетки (нейроны) в мозгах живых существ.
Чтобы выявить белки, запертые в компартментах биоклеток (отсеки, служащие для разграничения), в оптической микроскопии применяются флуоресцентные метки. Однако на оптическом микроскопе невозможно наблюдать ультрамикроструктуры, на базе которых складываются клеточные функции. Электронный микроскоп обладает разрешением, достаточным для наблюдения за ультрамикроструктурами, но, так как на нем невозможно увидеть флюоресцентную метку, присоединенную к молекуле, не получится идентифицировать белки внутри клетки. Вместо этого используют т. н. “маркировку иммуннозолотом”. То есть проверяют на электронном микроскопе расположение (локализацию) и форму т-клеток и тканей, задействуя свойство антител особым образом связываться с клетками и тканями, которые являются антигенами. В рамках данной техники используется метод изготовления тончайших ледяных срезов (техника Токуясу); за счет введения в образец сахарозы в качестве криопротектора она позволяет избежать образования кристаллов льда даже несмотря на относительно низкую скорость замораживания в случае, когда образец опускают в жидкий азот (~ <100°C-1). Затем ткань разрезают с помощью криоультрамикротомии и метят иммунозолотом.
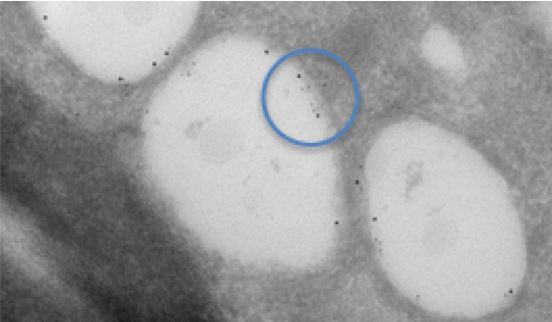
Рис. 1. Двойная маркировка липидных капель в клетке, инфицированной вирусом гепатита С. Для маркировки белков, представляющих интерес, используется коллоидное золото двух разных размеров; метки показывают, что каждый из белков располагается на внутренней мембране липидной капли. Ткань подготовлена, разрезана и маркирована с помощью техники Токуясу. Маркированные белки выделены синим кругом.
Анализ клеточных структур на SEM и TEM: значение для паразитологии
Для разработки антималярийных препаратов необходимо понимать, как организована клеточная и молекулярная структура малярии. Возбудители малярии (простейшие рода плазмодиум) развиваются внутри красных кровяных телец (эритроцитов) и замыкаются в паразитофорной вакуоли. В процессе развития малярия меняет характер поверхности эритроцитов, приводит к ригидизации цитоскелетов, создает “нажим” на цитоскелеты инфицированных клеток и продолжает распространяться. Также в случае полного прекращения развития малярийных возбудителей стартует процесс т. н. “выхода” (высвобождение после заражения). Для этого паразиты беспрерывно обеспечивают проницаемость мембраны и мастерски организуют процесс разрушения; в результате происходит взрывной выброс паразитов, спровоцированный разрушением клетки, и начинается новый этап инфекции.
Понимание этих процессов — ключ к прояснению жизненного цикла малярии. В подобных исследованиях эффективна электронная томография. Это методика реконструкции трехмерного изображения внутренних структур образца посредством компьютерной обработки большого количества изображений, отснятых при постоянных наклонах образца под разными углами. Профессор Флек изучил поверхности эритроцитов в трехмерном формате: рассмотрел на криоэлектронном томографе замороженный под давлением образец инфицированных эритроцитов (аморфный лед заменен на растворитель) и образец клеток-призраков (эритроцитов), подвергшийся мгновенной заморозке. Шишковидный нарост, покрытый плотным электронным слоем и обладающий высокоорганизованным цитоскелетом со спиральной структурой, формирует основу мембранной структуры и многочисленными связями соединяется с цитоскелетом эритроцита. Высокое разрешение крио-СЭМ дало профессору Флеку возможность рассмотреть схему расположения мембранных белков, входящих в структуру нароста. В качестве образцов были взяты срезы паразитов, замороженных под высоким давлением в живом виде. СЭМ-изображение в высоком разрешении показало структуры мембранных белков, помогло четко отделить структуру шишковидных наростов от окружающей их мембраны эритроцитов и позволило понять, что шишка прикрепляется к клетке вершиной. Таким образом было выяснено, что структура шишковидных наростов на эритроцитах, зараженных плазмодиум фальципарум, включает высокоорганизованный скелет, лежащий в основе специализированной области клеточной мембраны.
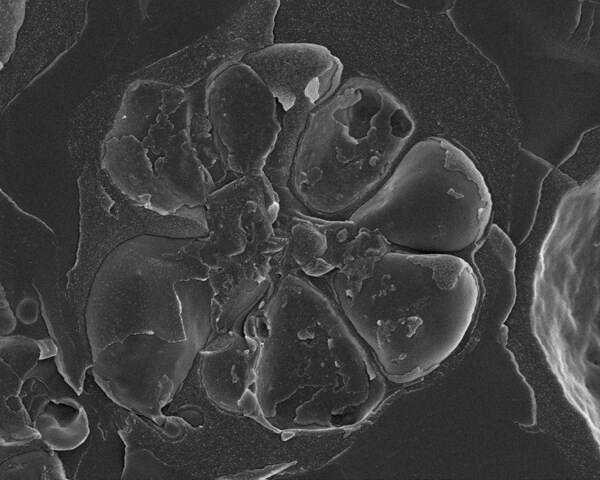
Рис. 2. Малярия, Плазмодиум фальципарум , паразиты, развивающиеся внутри красных кровяных телец (эритроцитов). В обернутой мембраной паразитофорной вакуоли содержатся семь мерозоитов. Мерозоиты располагаются вокруг центрального остаточного тельца. За счет дробления образца можно разглядеть каждую из множества мембран.
Трехмерное моделирование посредством SBF-SEM
Мозг — критически важная область исследований, так как за счет изучения нейрональных связей в мозге мы сможем понять механизмы обучения и памяти. Амбициозная цель на текущий момент — «коннектомный анализ», который раскрыл бы характер соединений между нервными клетками мозга. Что касается визуализации, ПЭМ позволяет рассмотреть нервные соединения, однако для наблюдения доступен лишь крайне узкий и малый участок. «Серийный блочный СЭМ (SBF-SEM) очень помогает преодолеть это ограничение», — отмечает профессор Флек.
SBF-SEM представляет собой методику реконструирования трехмерного изображения блока образца на сканирующем микроскопе. Применяется в построении трехмерных изображений мягких материалов, таких как нервные ткани, пропитанные смолой. Вмонтированный в камеру образца ультрамикротом отрезает от поверхности образца нервной ткани толщиной более пятисот микрон блоки приблизительно в тридцать микрон; после каждого среза в СЭМ происходит фотосъемка обнажившегося поверхностного слоя. Фотографии, собранные в результате многократного повторения этих операций, объединяются в трехмерное изображение образца.
Из-за применения методики SBF-SEM образец электризуется, что приводит к ухудшению качества данных полученного изображения. В этом случае, чтобы обеспечить электропроводность образца, прибегают к т. н. «методу ОТО» (тетраоксид осмия-тиокарбогидразид-тетраоксид осмия / osmium-thiocarbohydrazide-osmium). Этот метод был разработан задолго до появления SBF-SEM и применялся для повышения контрастности липидов. Профессор Флек адаптировал его для SBF-SEM: сделал возможным равномерное окрашивание образцов тканей, не допускающее образование значительного осадка от красителей, который порождает (излишне) сильный сигнал обратно отраженных электронов. С помощью этой техники профессор Флек проанализировал распределение структуры пресинаптической терминали внутри т. н. краевого слоя CAXNUMX— области гиппокампа (орган, который играет важнейшую роль в памяти и обучении), получающей от аксона упорядоченные сигналы. На базе множества изображений, полученных с разных областей, была восстановлена трехмерная модель; коллеги профессора сопоставили данные от синаптических сигналов (полученных электрофизиологическими методами) и эталонные маркеры внутри тканей мозга. Возбуждающие синапсы дендрита могут быть разных размеров, однако имела место значительная корреляция между пресинаптическими и постсинаптическими структурами. Чем дальше от клеточного тела находится синаптический бутон, формируемый на базальном дендрите пирамидного нейрона из области CA1 гиппокампа, тем меньше размер AZ (активная зона: область высвобождения нейротрансмиттера в пресинаптических структурах). Это, в свою очередь, связано с тем, что по мере отдаления от клеточного тела усиливается краткосрочная фасилитация нейротрансмиссии (повышение эффективности нейротрансмиссии за счет высокочастотных сигналов). Таким образом, пространственное распределение краткосрочной фасилитации, зависящее от расположения синапса на дендрите, компенсирует затухание входного электросигнала, когда сигнал передается клеточному телу от синаптической части в ходе многократного стимулирования, и настраивает подходящую частоту сигналов в дендрите.
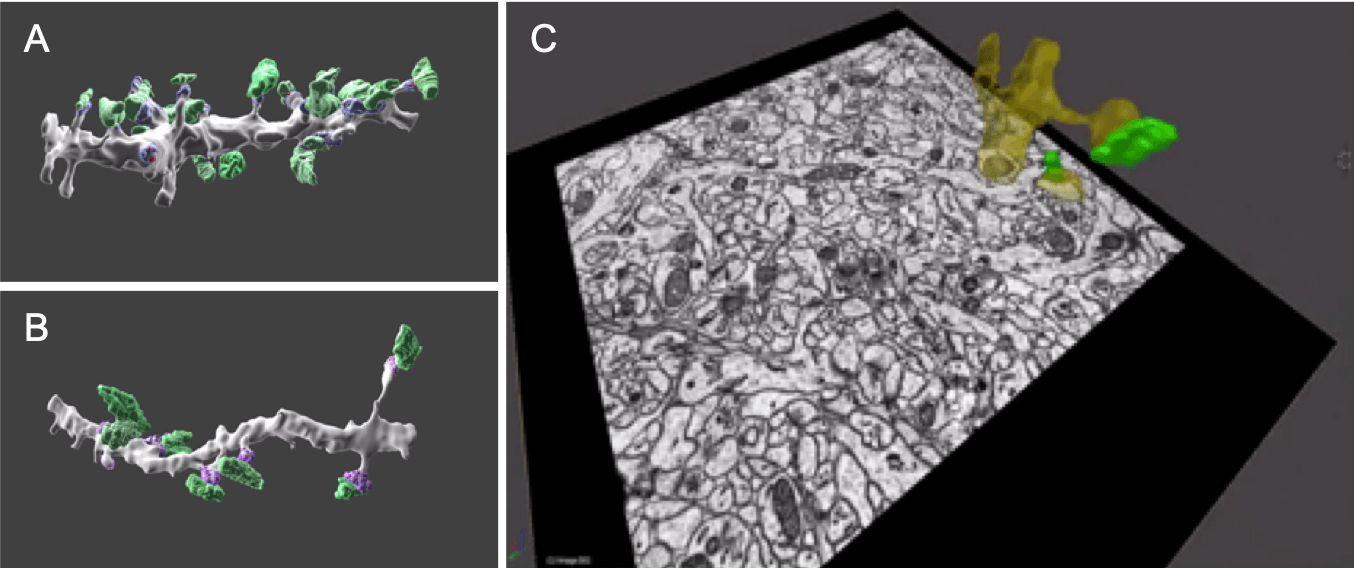
Рис. 3. 3D-изображение нервной клетки гиппокампа, сделанное на SBF-SEM. На изображениях А и В зеленым отмечены пресинаптические бутоны, фиолетовым — постсинаптические уплотнения; А — из проксимальной, а Б — из дистальной области дендрита. Изображение C показывает один из срезов последовательно раздробленного образца, а также восстановленные из наложенных друг на друга срезов дендрит (отмечен желтным) и пресинаптический бутон (отмечен зеленым). Благодаря наложению множества срезов возможна 3D-реконструкция структуры гиппокампа.
Корреляционная светоэлектронная микроскопия (CLEM): комбинация оптического и электронного микроскопов
Светоэлектронная микроскопия (CLEM) эксплуатирует взаимодополняющие свойства светового и электронного микроскопов. Сначала нужно определить позиции белков и тканей, отмеченных флуоресцентными метками, на флуоресцентном микроскопе. Затем на электронном микроскопе, обладающем более высоким разрешением, рассмотреть форму и структуру этих участков. CLEM часто применяется в биологии: методика позволяет проанализировать отмеченные флуоресцентными метками белки, функции тканей, формы (структуры) микроскопических участков. CLEM позволяет скомбинировать просвечивающий и сканирующий микроскопы; можно также установить специальный крио-столик и объединить функции флуоресцентного и крио-микроскопа. В CUI профессора Флека реализуются множество рабочих потоков, завязанных на CLEM. В частности, комбинация оптического микроскопа Nikon и сканирующего микроскопа JEOL способна визуализировать живые клетки, выращенные в специальной чаше для культивирования тканей. Такие чаши позволяют рассмотреть взаимосвязь между данными о внутриклеточных процессах, полученными от оптического микроскопа, и данными СЭМ о состоянии образца в результате обработки при комнатной температуре.
Центр передовых технологий JEOL для дальнейшего развития наук о жизни
Совмещая методы криоэлектронной микроскопии и структурной биологии, можно “на месте” выстраивать трехмерную клеточную структуру из срезов витрифицированных клеток и тканей, что открывает новый рубеж в клеточной биологии. Эта аналитическая методика требует не только наличия криоэлектронного микроскопа, но и инструментария для криофиксации и изготовления криосрезов. Кроме того, мы оптимизировали FIB-SEM (JIB-3F, производства JEOL), сочетающую систему сфокусированного ионного пучка (FIB) и SEM, таким образом, чтобы она могла работать с вышеуказанными инструментами: теперь можно с помощью FIB изготовить образец витрифицированной ламеллы и отправить его на просвечивающий микроскоп, не допуская малейшего загрязнения.
По словам профессора Флека, «За последние десять лет биологическая микроскопия совершила заметный скачок. В тесном партнерстве с JEOL мы разбираемся с новыми вызовами. В ходе разработки новейших приборов мы обмениваемся мнениями и предлагаем множество идей. Я невероятно горжусь своей причастностью к работе над инновациями будущего».
Важнейшую роль в социальной поддержке играет и Центр передовых технологий JCAT (JEOL Centre for Advanced Technology). JCAT обеспечивает местные больницы технологиями для диагностирования заболеваний почек и кожи. Так, электронный микроскоп JEM-1400Plus, оснащенный камерой RUBY производства JEOL, позволяет легко проводить биопсию.
Профессор Флек подчеркнул: «JCAT, образованный вместе с партнерами JEOL, станет важнейшей платформой. Благодаря нашему конструктивному сотрудничеству в этом центре рождаются идеи приборов и технологий, которые, я считаю, приведут к дальнейшему развитию наук о жизни».

Роланд Флек
Профессор Королевского колледжа Лондона, Великобритания
Профессор Флек изучал прикладную морскую биологию в Университете Хериота-Ватта в Эдинбурге, Шотландия, затем перешел в Институт пресноводной биологии, чтобы получить докторскую степень за исследования на тему «Механизмы повреждения и восстановления клеток у криоконсервированных пресноводных простейших». В ходе работы над диссертацией он впервые начал работать с электронными микроскопами JEOL JEM-100CX. После защиты диссертации перешел в Корнельский университет, чтобы исследовать акклиматизацию растений к холоду. Во время пребывания в Корнельском университете много работал с методом замораживания/скалывания. Впоследствии вернулся в Соединенное Королевство и перешел в Национальный институт биологических стандартов и контроля, где занимался разработкой и стандартизацией функциональных клеточных анализов, а также руководил и развивал местное оборудование для электронной микроскопии и криовизуализации. Покинул NIBSC, чтобы взять на себя пост директора Центра ультраструктурной визуализации в Королевском колледже Лондона.
Время публикации: март 2019 г.
