Замораживая изменчивые молекулярные структуры: криоэлектронная микроскопия раскрывает тайны жизни

ИНТЕРВЬЮ 07
Кэйити Намба
Профессор Высшей школы передовых биологических наук Университета Осаки
Все живые организмы состоят из белков; белки отвечают за множество функций: иммунитета, обмена веществ, функций головного мозга и подвижности. Профессор Кейити Намба, лидер группы протонных наномашин из Высшей школы передовых биологических наук Университета Осаки, стремится раскрыть секреты удивительных механизмов, лежащих в основе этих функций, изучая трехмерные (3D) структуры биологических молекул.
Понимание функций из структур
В человеческом теле содержится около ста тысяч разных видов белков. Каждый вид играет определенную роль: белки формируют ткани организма, отвечают за метаболизм (ферменты), через клеточную мембрану производят обмен питательными веществами, атакуют поступающие извне вещества (антитела) и т. д. Можно сказать, эти функции составляют саму жизненную активность.
«Белки — это своего рода “наномашины”, функционирующие в наших организмах. Мне безмерно интересно, какую роль играют эти крохотные механизмы, как они действуют», — делится профессор Кэйити Намба. Более сорока лет он работает над исследованиями функций белков, анализируя их структуры.
Белок — это макромолекула, представляющая собой цепочку от сотен до тысяч аминокислот. В состав белков входит всего двадцать аминокислот — за вычетом нестандартных. Словосочетание “цепочка из тысяч аминокислот” вероятно, вызывает в воображении образ некой цепи. Действительно, и в случае белка, и в случае цепи речь идет о ряде звеньев, но, в отличие от цепей, каждый белок обладает характерной для него объемной, трехмерной структурой. Длинная цепь аминокислот складывается сложным образом, причем одинаковые белки изгибаются в одних и тех же местах и под одним и тем же углом. И все же, бывает, белки с идентичными молекулярными структурами сворачиваются по-разному. Интересный факт: белки, различающиеся только трехмерной структурой, могут демонстрировать разные свойства. К примеру, фактором ГЭКРС (Губчатой энцефалопатии крупного рогатого скота), в начале двухтысячных годов взбаламутившей пищевую промышленность, считается не вирус и не лекарство, а белок под названием прион. Поразительно, но прион изначально присутствует в человеческом и коровьем мозге. Аномальный вид приона, ставший фактором ГЭКРС, отличался от нормального только участком трехмерной структуры. То есть для того, чтобы понять, как работает тот или иной белок, нужно не только подвергнуть лабораторному анализу его молекулярную структуру, но и рассмотреть его трехмерную структуру.
Сложные биологические молекулярные двигатели
Профессор Намба уже давно увлечен исследованиями 3D-структур биологических молекул. Особенно его интересует группа белков — т. н. “биологические моторы”. Свое название эти белки получили из-за того, что, подобно настоящим моторам, совершают вращательное движение либо перемещаются по прямой линии. Мускулы человека строятся из миофибрилл, состоящих из комбинации актина и миозина: линейные движения этих органелл вызывают мышечные сокращения. Сильнее всего на мотор похож “молекулярный двигатель”, обеспечивающий вращение жгутиков в форме хвоста у бактерий и нужный для управления подвижностью бактериальных клеток в вязких средах. Кишечная палочка и сальмонелла обладают несколькими жгутиками; при движении они соединяют эти жгутики и вращают ими, подобно пропеллеру, создавая таким образом тягу. Однако их структуры до сих пор не изучены.
Увлекшись загадкой, профессор проводил исследование за исследованием в попытке раскрыть трехмерные структуры. “Жгутиковый двигатель”, как и предполагает название, состоит из запчастей, “произведенных” белками тридцати видов, — ротора, статора, втулки; по строению он очень напоминает обычный электромотор. Мышечные волокна состоят из переплетенных филаментов актина и миозина, образующих чрезвычайно сложную шестиугольную решетку. Двигатель считается одним из самых потрясающих человеческих изобретений, но это предположение оказалось более чем высокомерным.
Координированные движения этих молекулярных моторов требуют энергии. Хотя было известно, что ионы водорода проходят через статорные каналы жгутикового мотора за счет градиента электрохимического потенциала через клеточную мембрану и что гидролиз АТФ актомиозином является источником энергии для мышечного сокращения, их высокая энергетическая эффективность была загадочной. Утверждалось, что может быть задействована энергия теплового броуновского движения, но механизмы ее использования были неизвестны. Источники тепла обеспечивают энергию для атомных и молекулярных флуктуаций, но когда объект рассматривается на атомном уровне, атомы и молекулы движутся в произвольных направлениях с произвольными скоростями.
Считалось, что даже молекулярные двигатели не могут создавать тягу в определенном направлении за счет случайных движений молекул и атомов, вызванных теплом. Однако на самом деле они движутся в одном направлении. Следовательно, существует механизм, исправляющий случайные движения.
Недавно профессор Намба подошел гораздо ближе к ответу. Он обнаружил, что актомиозин в мышечных волокнах устроен как храповик, который позволяет предпочтительное движение в одном направлении, но не в другом. Такая сложная система построена из белковых молекул с отчетливо асимметричной и динамичной трехмерной структурой.
Криомикроскопия как граница

Криоэлектронный микроскоп JEOL "CRYO ARM™" в лаборатории профессора Намбы
Вышеупомянутые результаты стали возможными благодаря детальной визуализации трехмерных структур белков и их комплексов. Структурный анализ с помощью рентгеновской кристаллографии был основным методом определения структуры белков. В этом методе образец кристаллизованного белка облучают рентгеновским лучом и измеряют интенсивность дифрагированных лучей. Рентгеновская кристаллография белков существует с 3-х годов, и с помощью этого метода было решено 1950% известных белковых структур.
Однако этот метод имеет большой недостаток: кристаллизация является необходимым условием для анализа, но это непросто. Кроме того, кристаллизация имеет тенденцию фиксировать белковые структуры в наиболее стабильном виде. Хотя молекулярные моторы существенно изменяют свою структуру при выполнении своих функций, они могут кристаллизоваться только в стабильных состояниях. Другими словами, невозможно наблюдать изменяющиеся трехмерные структуры.
Криоэлектронная микроскопия привлекает внимание как способ преодоления этого недостатка. Криоэлектронные микроскопы оснащены столиком для образца, называемым «криостолом», который позволяет поддерживать температуру сетки образца при сверхнизких температурах, например, в диапазоне от -160°C до -270°C. Молекулы белка в тонкой пленке раствора на дырчатой углеродной сетке мгновенно замораживаются с помощью жидкого этана для сохранения конформации «живого» состояния. Запись проекционных изображений с разных направлений с помощью криоэлектронного микроскопа позволяет получить трехмерную структуру этих белков в момент их функционирования. Кроме того, необходимо заморозить лишь небольшое количество раствора образца, и нет необходимости исследовать ряд условий кристаллизации.
Профессор Намба сосредоточился на криоэлектронной микроскопии и более 20 лет способствовал развитию методов анализа с помощью криоэлектронных микроскопов. Идентификация механизма действия актомиозина в мышечных волокнах — одно из достижений, которое стало возможным благодаря криоэлектронной микроскопии. Выявление деталей трехмерных структур жгутиковых моторов, о чем давно мечтал профессор Намба, больше не мечта.
«Почему действия таких крошечных веществ, как белки, приводят к видимому движению мышц? Это вопрос, который привел меня в эту область исследований в школьные годы. Теперь я чувствую, что смог ответить примерно на половину вопросов, которые я были те времена», — сказал профессор Намба.
Микроскоп, который является лучшим в мире

Профессор Като (слева) и профессор Намба управляют аппаратом CRYO ARM™ из отдельной комнаты.
Криоэлектронная микроскопия давно отстает от рентгеноструктурного анализа из-за недостаточной разрешающей способности первой. Электронные микроскопы облучают образцы интенсивным электронным пучком, электроны рассеиваются в образце, а линзы создают изображение образца в соответствии с рассеянием электронов. Однако, поскольку электронные лучи легко повреждают биологические молекулы, интенсивность пучка необходимо сильно ослабить с помощью низкодозовых методов, чтобы избежать радиационных повреждений. Мы можем видеть только туманное, шумное изображение, как если бы в темной комнате была только крошечная лампочка.
Однако многолетние усилия по развитию технологий помогли нам решить эту проблему. Что касается аппаратного обеспечения, камеры претерпели существенные улучшения. Обычные ПЗС-камеры преобразуют рассеянные электроны в свет перед созданием изображения, и в этом процессе генерируются и усиливаются различные типы шума. Таким образом, эффективность обнаружения не может быть улучшена. Однако появление CMOS-камер, способных напрямую регистрировать электроны для записи изображений, улучшило как чувствительность, так и разрешение и даже позволило скорректировать движение образца с помощью изображений с высокой частотой кадров. Таким образом, с помощью этих камер можно получить значительно улучшенное качество изображения.
Программное обеспечение для обработки изображений также претерпело заметные изменения. С помощью современного программного обеспечения можно легко получить сотни тысяч проекционных изображений белковых молекул во всех различных ориентациях с помощью криомикроскопа. Эти проекции разбиты на группы, каждая из которых содержит проекции одинаковой ориентации. Теперь изображения одного класса можно накладывать друг на друга для улучшения отношения сигнал/шум, что позволяет наблюдать детали с высоким разрешением. На последнем этапе многие средние значения класса объединяются в трехмерную структуру. Такая сложная обработка данных стала возможной на лабораторном уровне благодаря передовым вычислительным возможностям современных компьютеров.
CRYO ARM™, представленный в лаборатории профессора Намбы, разработан в соответствии с его требованиями к «лучшему в мире микроскопу». Цель разработки состояла в том, чтобы сделать возможным структурный анализ с разрешением выше 2.0 Å (1 Å или ангстрем эквивалентен 0.1 нм), что лучше, чем стандартная рентгеновская кристаллография. Кроме того, в CRYOARM™ можно загрузить несколько сеток для образцов и автоматически заменить их на предметный столик в любое время для удобства пользователей. Существенное сокращение времени, необходимого для сбора и анализа данных изображения, является одним из самых больших преимуществ этого микроскопа. Трехмерный структурный анализ, который раньше занимал один год 3 или 5 лет назад, теперь можно выполнить за неделю.
Прорыв не за горами
Профессор Намба считает, что трехмерная структура не только белков, но и любых других биомолекулярных комплексов, включая липиды и нуклеиновые кислоты, будет визуализирована через 3 лет.
Особенно важным приложением является анализ мембранных белков на поверхности клеток. Эти белки являются мишенью действия фармацевтических реагентов, а их трехмерный структурный анализ поможет выявить механизмы, лежащие в основе их молекулярной функции, значительно улучшить результаты терапии и сделать возможным разработку лекарств без побочных эффектов.
В будущем может даже произойти движение к промышленному применению биологических молекулярных двигателей, таких как суперэнергосберегающие машины, которые требуют минимального источника энергии и работают с использованием тепла окружающей среды в качестве основного источника энергии. Это парадоксальное представление может бросить вызов давнему мнению о машинах и технике.
Хотя мы все еще далеки от реализации таких изобретений, их реализация может оказаться не за горами.
β-галактозидаза, разрешение 2.6 Å CRYO ARM™
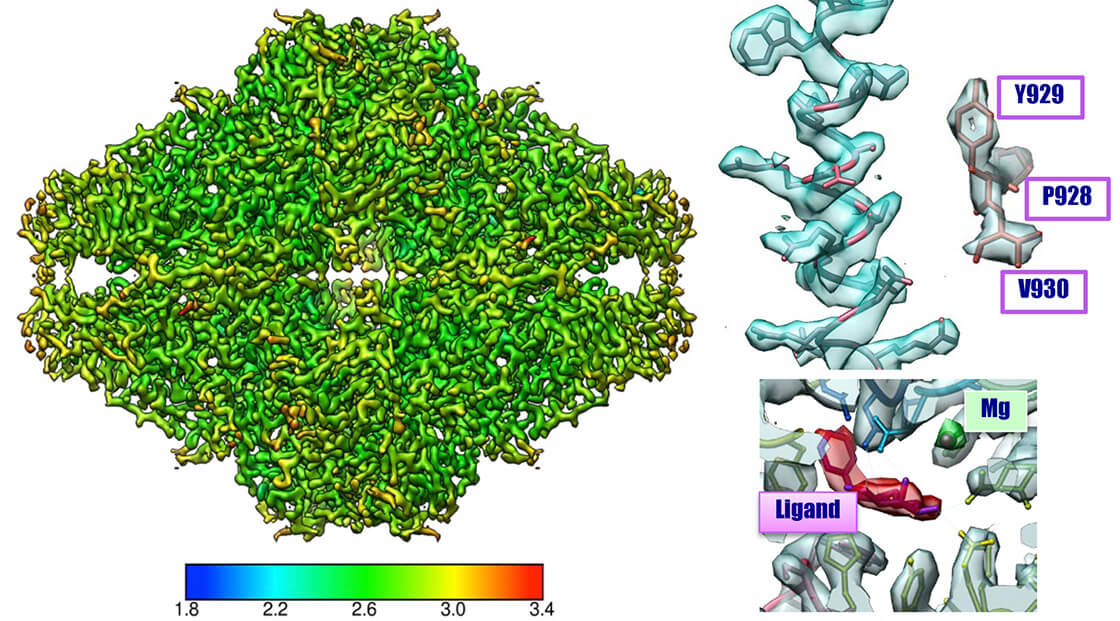
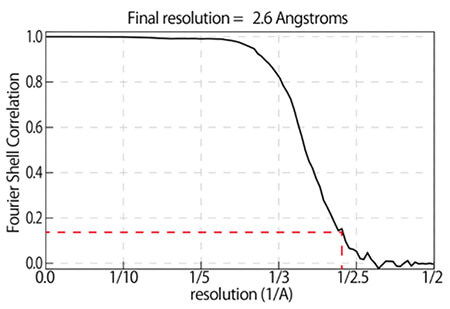
Пример:
β-галактозидаза с PETGМикроскоп:
CRYO ARM™ (Шоттки 200 кВ) / Вершина К2Количество изображений:
2,500 за 3 дня от JADASРазмер изображения в пикселях:
0.8 Å/пиксельКоличество изображений частиц:
350,000 88,564 (начальный пикап), 3 XNUMX (для окончательной XNUMXD-реконструкции)Программного обеспечения:
Motioncor2, Gctf, Gautomatch, Relion2.0Общая доза:
70 e-/Å2 (70 кадров (0.2 сек/кадры x 14 сек)
Данные: предоставлены доктором Т. Като и доктором К. Намба, Осакский университет, август 2017 г.

Кэйити Намба
Профессор Высшей школы передовых биологических наук Университета Осаки
После завершения докторантуры Высшей школы инженерных наук Университета Осаки он был назначен научным сотрудником Японского общества содействия развитию науки, научным сотрудником двух университетов США и руководителем группы Исследовательской корпорации развития Япония (нынешнее Японское агентство науки и технологий). Затем он занял должность директора по исследованиям в Международном институте перспективных исследований компании Matsushita Electric Industrial Co., Ltd. в 1992 г. Он занимает эту должность с 2002 г. Он специализируется в области биофизики, а также анализа структур и функций биомолекулярных комплексов, таких как молекулярные моторы.
Время публикации: октябрь 2017 г.
